Хіміки з США змоделювали та експресували в бактеріях білки, що зв'язуються з порфіриновими комплексами заліза, та використовували їх для каталітичного циклопропанування подвійних зв'язків та впровадження діазоз'єднань у зв'язку з кремнієм-вуглецем. В обох випадках, пишуть хіміки в Science, змодельовані de novo каталізатори виявилися ефективними без застосування спрямованої еволюції.
Реакції циклопропанування та впровадження у зв'язку елемент-водень можна проводити за допомогою металоорганічних каталізаторів. Зазвичай, у такому каталізаторі метал пов'язаний з хіральним лігандом, за рахунок якого продукт реакції утворюється у вигляді одного оптичного ізомеру. За такого підходу підібрати відповідний ліганд буває складно, і хімікам доводиться перебирати багато різних каталізаторів у пошуках найефективнішого.
Ще один підхід до асиметричного каталізу – це зв'язування металоорганічних каталізаторів із білками. І тут замість хиральних лігандів за селективність відповідає структура білка. Якщо структуру активного центру підібрано правильно, то амінокислотні залишки будуть «направляти» реакцію в активному центрі так, щоб вийшов лише один оптичний ізомер продукту. При цьому, якщо такий білковий каталізатор працює недостатньо добре, його структуру можна оптимізувати за допомогою спрямованої еволюції. Про те, як вона працює, ми розповідали у тексті «Гра у Бога».
Саме другий підхід нещодавно застосували хіміки під керівництвом Вільяма ДеГрадо (William F. DeGrado) із Каліфорнійського університету в Сан-Франциско. Їхня ідея була в тому, щоб змоделювати білкові каталізатори для реакцій циклопропанування алкенів та впровадження у зв'язку кремній-водень.
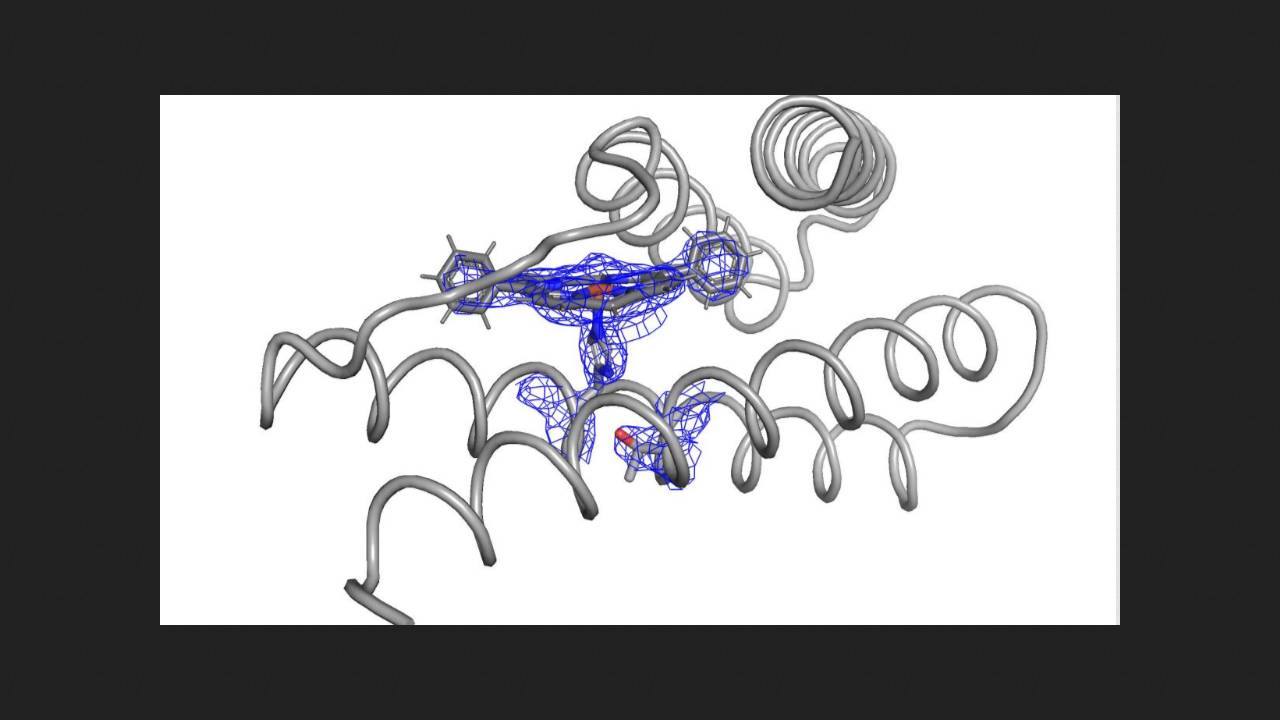
Спочатку хіміки взяли вже відомий каталітично активний білок з дифенілпорфіриновим кофактором (він утворює комплекс з іоном заліза) і протестували його в реакції циклопропанування стиролу етилдіазоацетатом. Продукт вийшов із виходом та енантіомерним надлишком у 40 відсотків. Тоді вчені припустили, що структура білка не дозволяє реагентам легко проникати в активний центр і через це вихід невисокий.
Щоб змоделювати на основі цього білка ефективніші каталізатори, вчені використовували кілька алгоритмів машинного навчання, у тому числі раніше розроблений у їх лабораторії. В результаті вони отримали набір з кількох десятків структур білків, з яких вибрали десять із найбільш певною структурою активного центру, та експресували їх у бактеріях. Більшість отриманих білків виявилися ефективними каталізаторами циклопропанування стиролу. Найкращий отриманий результат - кількісний вихід продукту та енантіомерний надлишок близько 99 відсотків.
Далі хіміки у такий же спосіб змоделювали структури білків для каталізу реакції впровадження діазоз'єднань у зв'язок кремній-водень. Але на цей раз замість дифенілпорфіринового кофактора вони вибрали протопорфірин IX, який виступає попередником гему в клітинах. Вибрані білки хіміки знову експресували у бактеріях, і вони виявилися ефективними каталізаторами. Крім того, вченим вдалося додатково підвищити енантіоселективність впровадження за допомогою спрямованої еволюції отриманих каталізаторів у живих клітинах. Це спрацювало завдяки тому, що вчені вибрали клітинний метаболіт протопорфірин IX як кофактор.
Так хімікам удалося отримати набір білкових каталізаторів для двох реакцій. Незважаючи на високу ефективність отриманих каталізаторів, невеликі зміни в структурі вихідних речовин часто призводили до падіння виходу та енантіоселективності.
Раніше ми розповідали про те, як хіміки використовували ліпазу дріжджів у комбінації з рутенієвим каталізатором для енантіоселективного синтезу макроциклів.