Російські вчені знайшли в терапевтичному фаговому коктейлі для лікування бактеріальних інфекцій невідомий раніше бактеріофаг Sxt1, здатний інфікувати низку диких штамів кишкової палички, стійких до фагів з тієї самої родини. Порівнявши Sxt1 із спорідненими фагами Т3 і Т7, вчені виявили, що секрет його ефективності криється в будові хвостових фібрил. Результати дослідження опубліковані у журналі Viruses.
Одним із рішень проблеми резистентності бактерій до антибіотиків є лікування бактеріальних інфекцій за допомогою бактеріофагів - вірусів, що заражають бактерії. Але фаги вузькоспецифічні і можуть інфікувати лише певні штами одного виду бактерій, тому в терапії використовують фагові коктейлі - суміші різних фагів, що мають активність щодо різних штамів одного або декількох видів бактерій. Однак через відсутність даних про клінічну ефективність терапевтичних фагових коктейлів їх застосування обмежене.
Група вчених з Лабораторії аналізу метагеномів зі Сколтеха під керівництвом Артема Ісаєва (Artem Isaev) вивчила склад терапевтичного фагового коктейлю «Секстафаг (піобактеріофаг полівалентний)», що випускається російською компанією «Мікроген», і виділила новий бактеріофаг Sxt1. coli, у тому числі й деякі з них, стійкі до інших, споріднених до нього фагів.
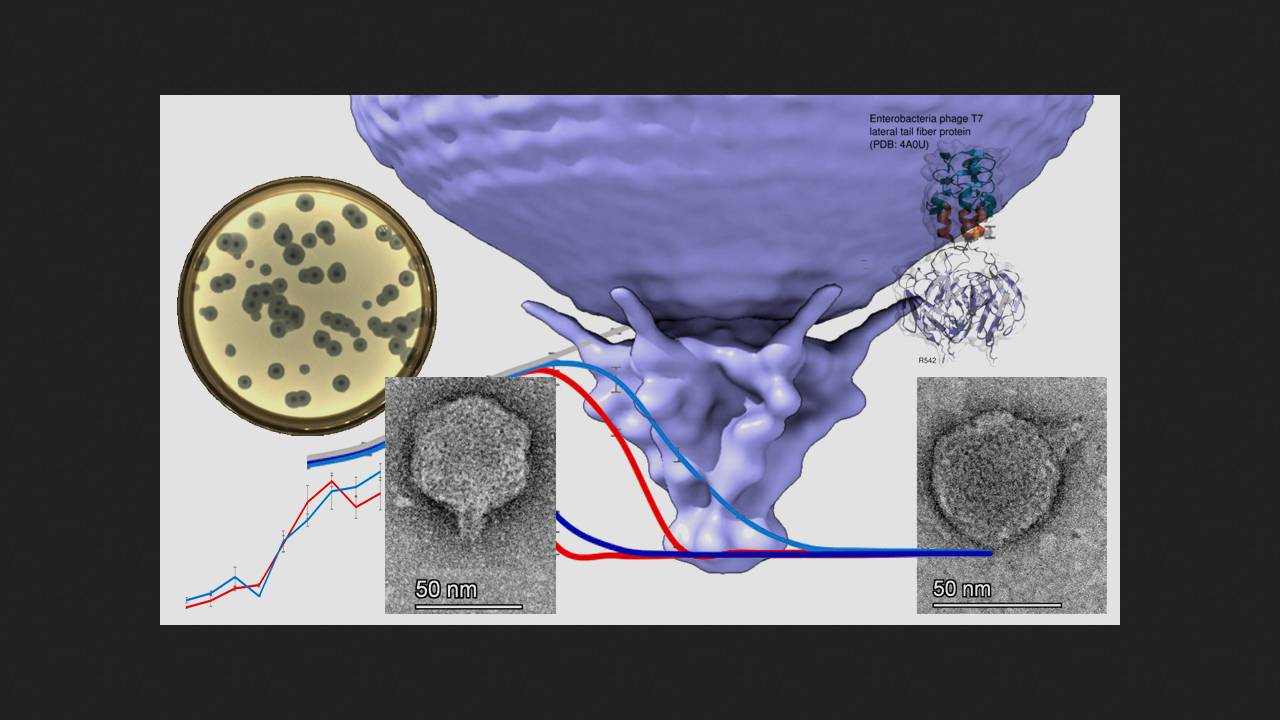
Поліфаговий коктейль "Секстафаг" містить фаги, виділені з бактерій Staphylococcus spp., Streptococcus spp., Proteus (Р. vulgaris, P. mirabilis), P. aeruginosa, Klebsiella pneumoniae та ентеропатогенної E. coli. У ході дослідження вчені використовували як господар штам E. coli BW25113. З коктейлю був виділений фаг Sxt1 із сімейства Autographiviridae, який виявився близьким родичем фагів кишкової палички Т3 і Т7. У фагів із цього сімейства є РНК-полімераза, яка транскрибує ряд генів фага. Попередні гени (гени, що транскрибуються відразу після зараження бактеріальної клітини) Sxt1, ранні (задіяні в метаболізмі ДНК та реплікації геному фага), а також частина пізніх генів (кодують структурні компоненти віріонів фага, його упаковки та лізис бактерії) були практично повністю ідентичні генам фага. Відмінності Sxt1 від споріднених фагів виявлені в генах, що кодують хвостові фібрили і два внутрішні білки, і є, на думку вчених, результатом рекомбінації фагів, імовірно з фагом Berlinvirus.
Исследователи построили филогенетическое древо бактериофагов подсемейства Studiervirinae, куда входит Sxt1, определили его предполагаемое происхождение и пришли к выводу, что секрет его исключительности кроется именно в белке латеральных хвостовых фибрилл. Фаги из семейства Autographiviridae для прикрепления к бактериальной клетке используют шесть хвостовых фибрилл, каждая из которых состоит из тримера этого белка. На концах тримера имеются участки, контактирующие с поверхностью клетки. N-концевой домен необходим для прикрепления к капсиду, длинный пирамидальный домен включает в себя бета-листы от каждой из трех молекул, входящих в состав тримера, за ним расположен короткий альфа-спиральный линкер и концевой домен, отвечающий за взаимодействие с бактериальной клеткой. Пирамидальный домен Sxt1 содержал шесть вставок длиной более пяти аминокислот, причем некоторые из вставок образовывали дополнительные бета-слои. Линкер также включал в себя дополнительную вставку из 27 аминокислот. В итоге за счет вставок хвостовая фибрилла Sxt1 длиннее, чем у Т3 и Т7. С помощью программы AlphaFold2 ученым удалось смоделировать концевой домен Sxt1 с альфа-спиральным линкером и часть пирамидального, и оказалось, что она только на 43 процента идентична аналогичной области фага Т3 и на 54 процента — фага Т7. При этом хвостовые фибриллы Sxt1 распознают иной набор рецепторов бактериальной клетки по сравнению с Т3 и Т7.
Для оценки специфичности нового фага исследователи высеяли фаги Sxt1, T7 и T3 на распространенные штаммы E. coli: BW25113, MG1655, BL-21, B, C, DH5α, HS и Nissle1917, а также на штаммы F+ BW39773 и KD263, которые способны ингибировать T7 из-за наличия системы абортивной инфекции PifA. Устойчивыми ко всем фагам оказались только штаммы HS и Nissle1917. Все остальные штаммы E. coli фаг Sxt1 успешно инфицировал. При этом Т3 не смог заразить штаммы линии К12, а Т7 потерпел неудачу со штаммами с системой PifA.
Для визначення спектру господарів фагу Sxt1 вчені перевірили, як він взаємодіє з різними штамами кишкової палички. Бактерії E. coli діляться на серогрупи за будовою О-антигена - полісахариду на зовнішній мембрані клітинної стінки, що відрізняється високою варіабельністю і дозволяє бактеріям уникати захисної дії адаптивного імунітету. Дослідники припускають, що О-антигени – одна з основних перешкод для розпізнавання бактерії фагами. Тобто, чим вища специфічність фага до О-антигенів бактерій, тим ефективніший він для фагової терапії. Дослідники використовували колекцію ECOR - набір природних ізолятів E. coli з типами О-антигенів, що розходяться, і перевірили, як на різні штами діють фаги Sxt1, T3 і T7. Фаг Sxt1 зміг інфікувати 15 із 72 штамів колекції (20 відсотків), включаючи всіх бактерій, сприйнятливих до T7 та/або T3, та ще 7 штамів, стійких до цих фагів. Тоді дослідники проаналізували дію фага на штам ECOR50, який чутливий до Sxt1, але не до T7 або T3, і виявилося, що тільки Sxt1 здатний зв'язуватися з поверхнею. Тобто, причина ефективності Sxt1 криється у його вмінні розпізнавати рецептори бактерії, а не у підвищеній стійкості до захисних систем клітини.
Вчені дійшли висновку, що фаг Sxt1 з розширеним спектром господарів ефективніший за своїх родичів — фагів Т3 і Т7. Він має великий потенціал для терапевтичного застосування при інфекціях, викликаних E. coli, а оцінка його специфічності могла стати стандартною процедурою для характеристики бактеріофагів.
В останні роки у світлі боротьби з антибіотикорезистентністю ведеться активний пошук нових бактеріофагів, а також розробка методів їхньої модифікації. 2021 року американські вчені вбудували в бактеріофаг систему CRISPR/Cas9, що дозволило націлити його на конкретний штам кишкової палички. У тому ж році португальські вчені створили синтетичні бактеріофаги, що вражають синьогнійну паличку.