Американські дослідники розробили фармакологічно активний гідрогель для профілактики післяопераційного спайкоутворення. В експериментах на свинях він ефективно запобігав розвитку спайок після втручань на кишечнику, не порушуючи загоєння і без системної токсичності. Звіт про роботу опубліковано в журналі Science Translational Medicine.
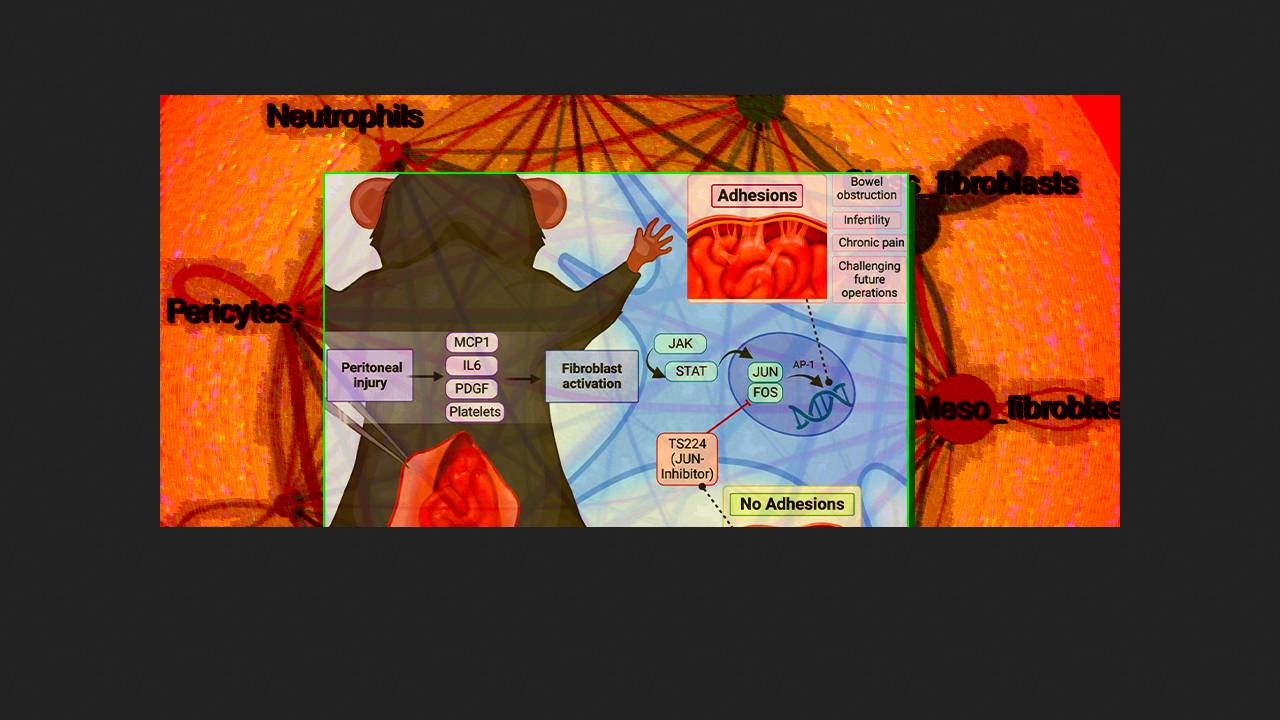
Спайки утворюються після 50-90 відсотків операцій на черевній порожнині, служать основною причиною кишкової непрохідності, можуть викликати хронічні болі та безплідність, а також ускладнювати подальші хірургічні втручання. Крім дискомфорту та погіршення якості життя вони створюють додаткове навантаження на систему охорони здоров'я та призводять до великих фінансових витрат. Способів профілактики та лікування спайок з підтвердженою ефективністю нині немає, багато в чому через недостатнє розуміння механізмів їх утворення та патогенезу спайкової хвороби.
У 2020 році група дослідників зі Стенфордського університету під керівництвом Майкла Лонгейкера (Michael Longaker) представила результати фундаментального аналізу спайкових тканин миші та людини. За їхніми даними, спайки утворюються переважно з вісцеральної очеревини в результаті поліклональної проліферації тканинних фібробластів, які синтезують рубцеву тканину, що фіксує внутрішньочеревні структури та іммобілізує кишечник. Основним регулятором цього процесу (адгезіогенезу) є фактор транскрипції Jun, який разом з білком Fos формує комплекс AP-1 і запускає процес проліферації та синтезу позаклітинного матриксу. Низькомолекулярний інгібітор комплексу AP-1 T-5224 в експерименті на мишах пригнічував післяопераційну експресію Jun та обмежував утворення спайок.
Щоб транслювати ці дані в клінічну практику, в новій роботі Лонгейкер з колегами помістили T-5224 в гідрогель гідроксипропілметилцелюлози з модифікованими бічними гідрофобними ланцюгами і пошили їх біосумісними міцелами детергенту твіна. Бар'єрні функції цього матеріалу виявляють синергію з фармакологічною дією T-5224, а консистенція дозволяє наносити на очеревину на місці операції за допомогою шприца або спрею. Експерименти підтвердили, що гідрогель має оптимальні реологічні властивості та при мілімолярній концентрації активного препарату стійко вивільняє його протягом 14 днів — клінічно критичного часу для утворення спайок.
После успешных испытаний гидрогеля на мышах исследователи приступили к опытам на минипигах, устройство желудочно-кишечного тракта и развитие спаечной болезни у которых близко к человеческим. Для этого они разработали и проверили модель спайкообразования, включающую лапаротомию по средней линии, ревизию брюшной полости, резекцию тонкой кишки с ручным наложением анастомоза, скарификацию брюшины правой боковой стенки, промывание изотоническим солевым раствором и ушивание брюшной стенки. Замещение в этой модели солевого раствора на гидрогель с T-5224 приводило к значительно меньшему образованию спаек при ревизии через четыре недели как макроскопически, так и гистологически (в обоих случаях p < 0,0001), причем сформировавшиеся волокна матрикса в присутствии гидрогеля были менее зрелыми и плотными. Анализы показали, что T-5224 хорошо всасывался клетками местно, а его концентрация в крови была низкой и уменьшалась со временем. Признаков гематологической, печеночной и почечной токсичности, влияния на массу тела, а также гистологических изменений внутренних органов выявлено не было. На заживление кишечных анастомозов (в том числе при высокожировой диете) и их механические свойства, а также на регенерацию поврежденной кожи внутрибрюшинное введение гидрогеля значимо не влияло. Секвенирование отдельных клеток спаечной ткани показало, что использование активного препарата подавляло сигнальный путь Jun, причем эффекты этого были значительно более выраженными в мезотелиальных фибробластах, способствующих формированию фиброзных рубцов, чем в ремоделирующих фибробластах, предположительно отвечающих за регенерацию тканей после операции. Таким образом, гидрогель с T-5224 стойко препятствует образованию послеоперационных спаек брюшины без негативного влияния на состояние кишечного анастомоза и заживление брюшной стенки, а также без признаков системной токсичности. Учитывая, что биологические механизмы образования спаек схожи в различных областях хирургического вмешательства, препарат имеет потенциал к применению практически в любых анатомических локациях, считают авторы работы. Гидрогели различных составов находят применения в разных областях экспериментальной медицины: к примеру, их использовали для лечения инфаркта миокарда, закрытия язвы желудка, заживления ран при диабете, борьбы с раневыми инфекциями, повышения эффективности вакцин и соединения капилляров.