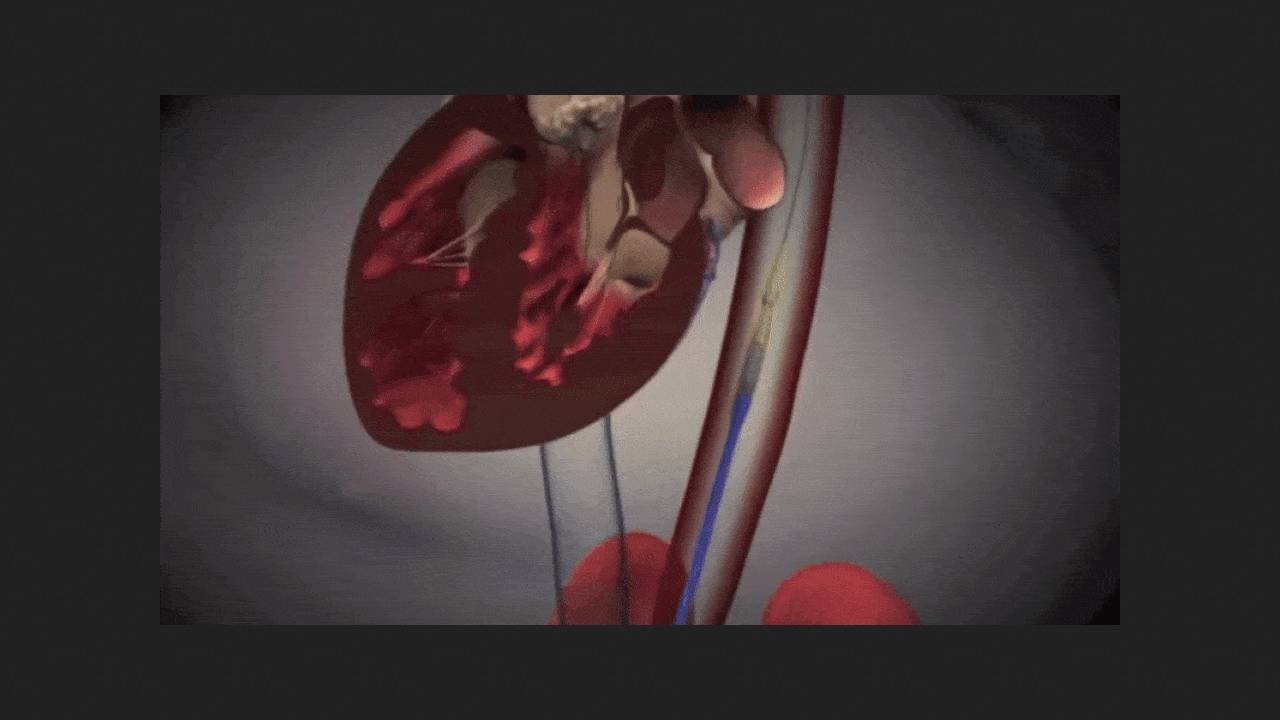
Управління контролю якості харчових продуктів та лікарських засобів США (FDA) вперше схвалило до застосування транскатетерне протезування аортального клапана серця (TAVR) при безсимптомному тяжкому аортальному стенозі. Ліцензію одержала система SAPIEN 3 компанії Edwards Lifesciences. Як підкреслено в прес-релізі компанії, без лікування кожен десятий пацієнт із симптомами важкого аортального стенозу вмирає протягом п'яти тижнів після їх появи, при цьому вони можуть розвиватися несподівано та прогресувати швидко та непередбачено. Тим не менш, досі TAVR було показано лише за наявності клінічних проявів захворювання.
Приводом для вирішення управління стали результати мультицентрових рандомізованих контрольованих клінічних випробувань EARLY TAVR, у яких взяв участь 901 пацієнт із безсимптомним тяжким аортальним стенозом. 455 з них виконали TAVR, решту 446 залишили під динамічним наглядом згідно з діючими рекомендаціями. Протягом медіанного періоду спостереження у 3,8 року смерть, інсульт чи позапланова госпіталізація з серцево-судинних причин відбулася у 26,8 відсотка учасників в основній групі проти 45,3 відсотка у контрольній (p < 0,001).