Американські вчені повідомили про відкриття нової популяції нейронів-мішеней для гормону жирової тканини лептину. Ними виявилися нейрони дугоподібного ядра гіпоталамуса, що експресують базонуклін 2. Під впливом лептину ці нейрони безпосередньо пригнічують AgRP-нейрони і тим самим пригнічують апетит у мишей. Дослідження опубліковано в журналі Nature.
Лептин, що виробляється жировою тканиною, підтримує гомеостатичний контроль маси жирової тканини шляхом регуляції споживання їжі та енергетичного балансу. Це відбувається за рахунок інгібування AgRP-нейронів та нейронів, що експресують нейропептид Y, а також активації нейронів, що експресують гіпоталамічний проопіомеланокортин (POMC-нейрони). Всі ці нейрони знаходяться в дугоподібному ядрі гіпоталамуса.
Загалом дві популяції нейронів - AgRP-нейрони і POMC-нейрони - антагоністично регулюють споживання їжі, опосередковане лептином. Однак функціональні ефекти і динаміка процесів цих нейронів розрізняються в кількох важливих аспектах, і ряд даних вказує на існування інших нейронних популяцій, чутливих до лептину, які можуть вирішальне значення для керованого лептином контролю споживання їжі та маси тіла.
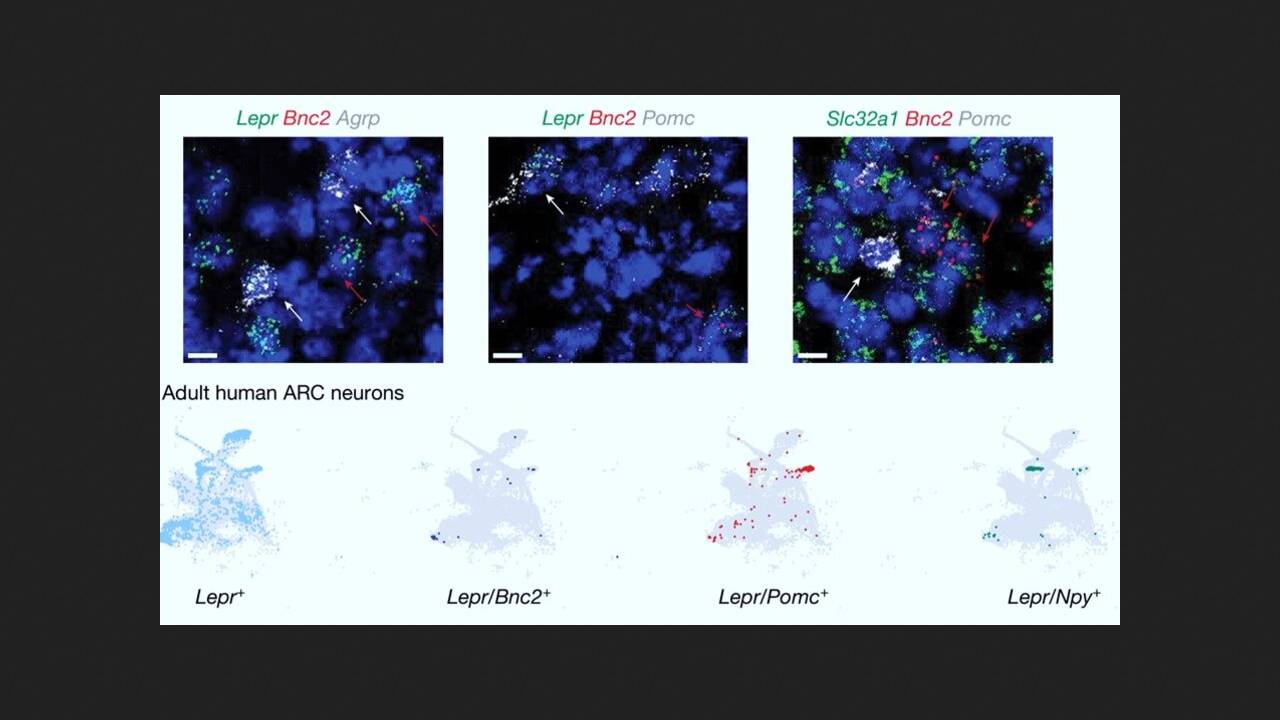
Дослідники під керівництвом Джеффрі Фрідмана (Jeffrey Friedman) з Рокфеллерівського університету провели систематичне профільування транскриптомів нейронів дугоподібного ядра гіпоталамуса мишей з використанням одноядерного РНК-секвенування. З'ясувалося, що в одному з кластерів присутні раніше не описані нейрони, що експресують рецептор лептину. Ними виявилися нейрони, що експресують базонуклін 2 (BNC2-нейрони) - білок сімейства базонуклін-цинкових пальців, який бере участь у регуляції сплайсингу мРНК, процесингу, транскрипції та відіграє важливу роль у ранньому ембріональному розвитку.
Для подальшого вивчення динаміки та функціонування BNC2-нейронів вчені вивели лінію мишей з нокаутом гена BNC2. Експерименти показали, що BNC2-нейрони реагують на сенсорні сигнали, пов'язані з їжею, залежно від досвіду, і споживання їжі ще більше активізує ці нейрони. В експерименті мишам, які голодували протягом ночі, на дві чи десять хвилин давали їжу. Після того, як їжу прибирали, активність BNC2-нейронів швидко знижувалася, і, навпаки, вона залишалася високою при постійному доступі до їжі.
Подальші молекулярні дослідження показали, що частина сенсорних сигналів, які пригнічують AgRP-нейрони та знижують апетит після їди, передаються BNC2-нейронами. Потім кілька дослідів показали, що лептин підвищує активність BNC2-нейронів. Вони, у свою чергу, безпосередньо пригнічують активність AgRP-нейронів, що призводить до придушення апетиту.
Видалення рецепторів лептину в BNC2-нейронах викликало надмірне підвищення апетиту та призводило до ожиріння у мишей. Подібні зміни спостерігалися і при нокаут генів рецепторів лептину в AgRP-нейронах. Вчені також спостерігали поліпшення толерантності до глюкози та підвищення чутливості до інсуліну у мишей після активації BNC2-нейронів.
Таким чином, вчені приходять до висновку, що популяція BNC2-нейронів у дугоподібному ядрі гіпоталамуса безпосередньо та швидко регулює харчування та енергетичний баланс. Ці результати додають новий важливий компонент у нейронний ланцюг, відповідальний за апетит та його порушення, та додають знань про механізми, за допомогою яких лептин регулює цю систему. Потенційно, фармакологічна активація цих нейронів може мати терапевтичне значення зниження ваги.
Раніше ми розповідали, що смак та запах їжі індукує фрагментацію мітохондрій у печінці через активацію POMC-нейронів.