Китайські та американські дослідники повідомили про успішний експеримент з лікування важкої системної склеродермії у пацієнтки готовим препаратом NK-лімфоцитів з химерним антигенним рецептором, отриманих з донорських індукованих стовбурових плюрипотентних клітин. Звіт опубліковано в Cell.
Технологія химерних антигенних рецепторів (про неї можна почитати в матеріалі Хімера проти раку) спочатку розроблялася для модифікації Т-лімфоцитів при лікуванні пухлин. Найбільших успіхів у її застосуванні досягнуто при В-клітинних онкозахворюваннях, оскільки В-лімфоцити мають високоспецифічні антигени CD19 і BCMA, що становлять хорошу мішень для CAR-Т-терапії. Також у клінічних випробуваннях подібний підхід успішно застосовували для терапії різних аутоімунних захворювань (редакція журналу Science, як і Nature, назвала ці експерименти одним з основних наукових досягнень 2024 року), оскільки в їхньому патогенезі ключову роль відіграють В-клітини. Всі ці схеми лікування вимагають виділення аутологічних Т-лімфоцитів з крові пацієнта, впровадження в них трансгену CAR на вірусному векторі в лабораторії, розмноження та введення назад в організм. У більшості пацієнтів після інфузії CAR-Т-лімфоцитів розвиваються типові ускладнення: синдром викиду цитокінів, нейротоксичний синдром ICANS або гіперзапальний синдром IEC-HS різного ступеня тяжкості.
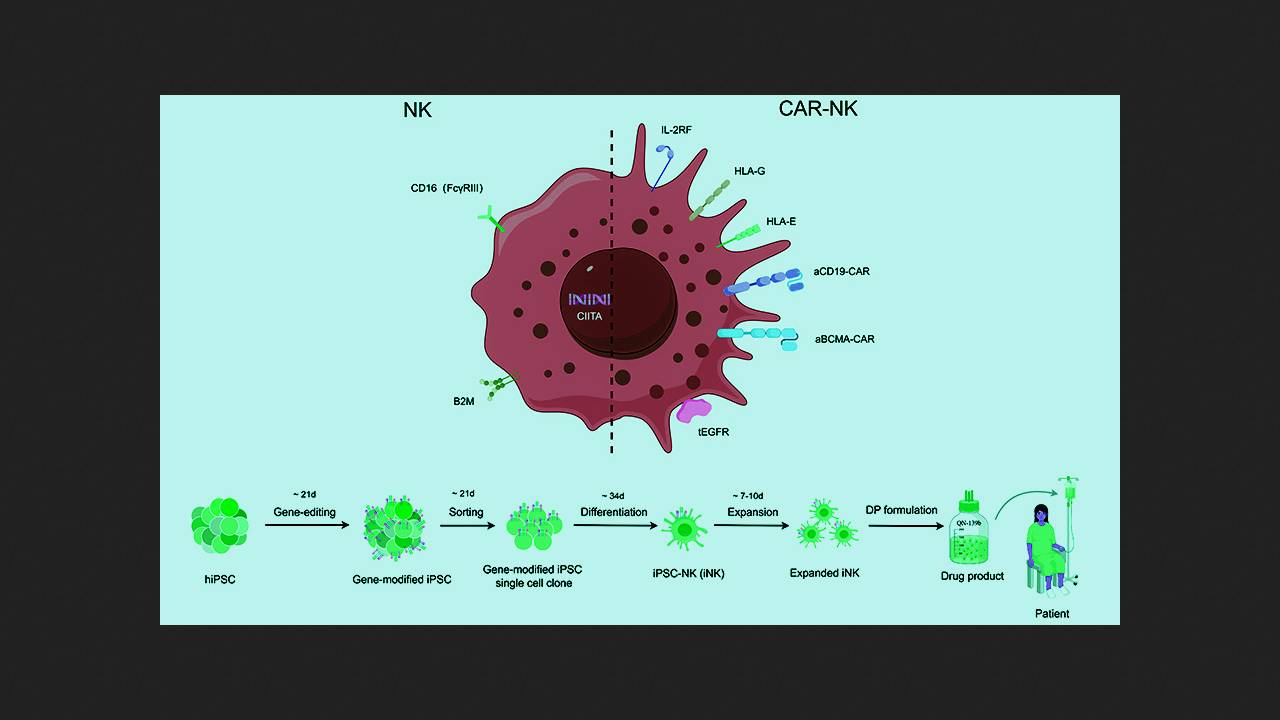
У ході доклінічних та пілотних клінічних випробувань використання NK-лімфоцитів з химерним антигенним рецептором (CAR-NK-лімфоцитів) показувало значно меншу токсичність та потенційно більш високу ефективність порівняно з CAR-T-лімфоцитами при лікуванні В-клітинних. Хуцзі Сюй (Huji Xu) з Військово-морського медичного університету та Університету Цинхуа з колегами та співробітниками компанії Qihangene Biotech вирішили випробувати CAR-NK-клітини при тяжкому, стійкому до терапії аутоімунному захворюванні, причому використовувати для їх виготовлення NK-лімфоцнор. стовбурових клітин (ІПСК). Такий підхід покликаний спростити, здешевити та стандартизувати процедуру, а також надати пацієнтові готовий препарат без часу очікування.
При создании экспериментального препарата QN-139b исследователи генетически донорские ИПСК с помощью редактора цитозиновых оснований для нокаута генов и системы CRISPR/Cas9 для сайт-специфичной интеграции желаемых модификаций. Успешно модифицированные клетки клонировали в культуре и дифференцировали в NK-лимфоциты. Внесенные модификации включали нокаут компонент главного комплекса гистосовместимости B2M и CIITA для предотвращения распознавания Т-клетками реципиента, а также нокаут мембранного иммуноглобулина CD16 и нокин человеческих лимфоцитарных антигенов (HLA) G и E для минимизации активации NK-клетками пациента. Кроме того, в клетки внесли конструкты, экспрессирующие рецепторы интерлейкина-2 (IL-2RF) для усиления активации и персистирования и рецептор эпидермального фактора роста (tEGFR) в качестве «аварийного выключателя» анти-EGFR антителами. Полученные клетки снабдили двумя типами CAR, нацеленными на CD19 и BCMA, отобрали успешно модифицированные, оценили их проточной цитометрией и анализом на функциональные маркеры и испытали на клеточных культурах и мышах.
Для участия в клиническом эксперименте авторы работы пригласили 36-летнюю женщину с тяжелой диффузной кожной системной склеродермией. В 16 лет у нее выявили синдром Рейно и высокий уровень (+++) специфичных для заболевания анти-Scl-70 антител. К 18 годам появились утолщения кожи конечностей, прогрессирующая эритема и боль в суставах, со временем кожные проявления распространились на лицо, шею и грудную клетку. За три года до поступления у женщины выявили интерстициальное поражение легких, непосредственно перед ним — умеренный фиброз миокарда с сохранной фракцией выброса. Многолетняя терапия метилпреднизолоном, циклофосфамидом, гидроксихлорохином, метотрексатом, микофенолата мофетилом, тоцилизумабом и нидабусиба этансульфонатом прогрессирование заболевания не остановила.
После лимфодеплеции пациентке провели четыре внутривенных инфузии 600 миллионов клеток QN-139b с интервалом в три дня. Пиковая концентрация CAR-NK-клеток (270 на миллилитр крови) и их доля в общем числе лимфоцитов (2,74 процента) наблюдались на седьмой день от первой инфузии и вернулись почти на исходный уровень к двенадцатому. Сразу после инфузии произошло резкое снижение уровня периферических В-лимфоцитов, который начал восстанавливаться через два месяца и продолжал через полгода, причем с преобладанием наивных В-клеток (что свидетельствует о перезагрузке иммунной системы). Также на фоне лимфодеплеции резко снизились уровни Т- и NK-лимфоцитов, которые начали восстанавливаться через две недели и продолжали через полгода. В течение шести месяцев наблюдались прогрессирующее снижение уровней аутоантител анти-Scl-70 и анти-SSA/Ro52, нормализация уровней компонент системы комплемента C3 и C4, стабильный уровень иммуноглобулина G, существенное снижение уровней иммуноглобулинов А и М и нормализация уровня иммуноглобулина Е (до лечения в разы повышенного).
Клінічно спостерігалося зменшення проявів захворювання за шкалою EUSTAR-AI з 3,68 до 1,33 балів до шостого місяця; за трьома або більше з п'яти пунктів шкали CRISS покращення склало не менше 20 відсотків до першого місяця, 30 відсотків — до другого та 50 відсотків — до третього. Регресія шкірного фіброзу, набряку та еритеми спостерігалася візуально, ультрасонографічно, еластографічно та гістологічно; фіброз легень також значно зменшився, міокарда - майже вирішився. Стан мікроциркуляторного русла при капіляроскопії став значно кращим з ознаками зростання нових судин. Кількісний протеомний аналіз крові виявив підвищену експресію білків, пов'язаних з ангіогенезом, пригніченням проліферації сполучної тканини, реакцією на окислювальний стрес та імуносупресією, та знижену – з активацією імунітету, запаленням та фіброзом. Істотних побічних реакцій на терапію виявлено був, рівень маркера запалення С-реактивного білка коливався межах нормальних значень, температура тіла не підвищувалася.
Результати пілотного клінічного експерименту показують, що CAR-NK-лімфоцити з донорських стовбурових клітин можна розглядати як перспективний метод терапії важких аутоімунних захворювань, стійких до прийнятих схем терапії.
На початку 2025 року американські дослідники повідомили про успіх перших клінічних випробувань готового препарату CAR-NK-лімфоцитів з донорських ІПСК (FT596), у яких взяли участь 86 пацієнтів з рефрактерною або рецидивною В-клітинною лімфомою.