Дослідники із семи країн представили попередні результати третьої фази клінічних випробувань ex vivo CRISPR-терапії важких форм серповидноклітинної анемії та бета-таласемії у дітей віком до 12 років. Ефективність препарату у перших кількох пацієнтів досягла 100 відсотків при добрій переносимості. Доповідь про це прозвучала на 67-му щорічному зльоті Американського гематологічного товариства ASH 2025.
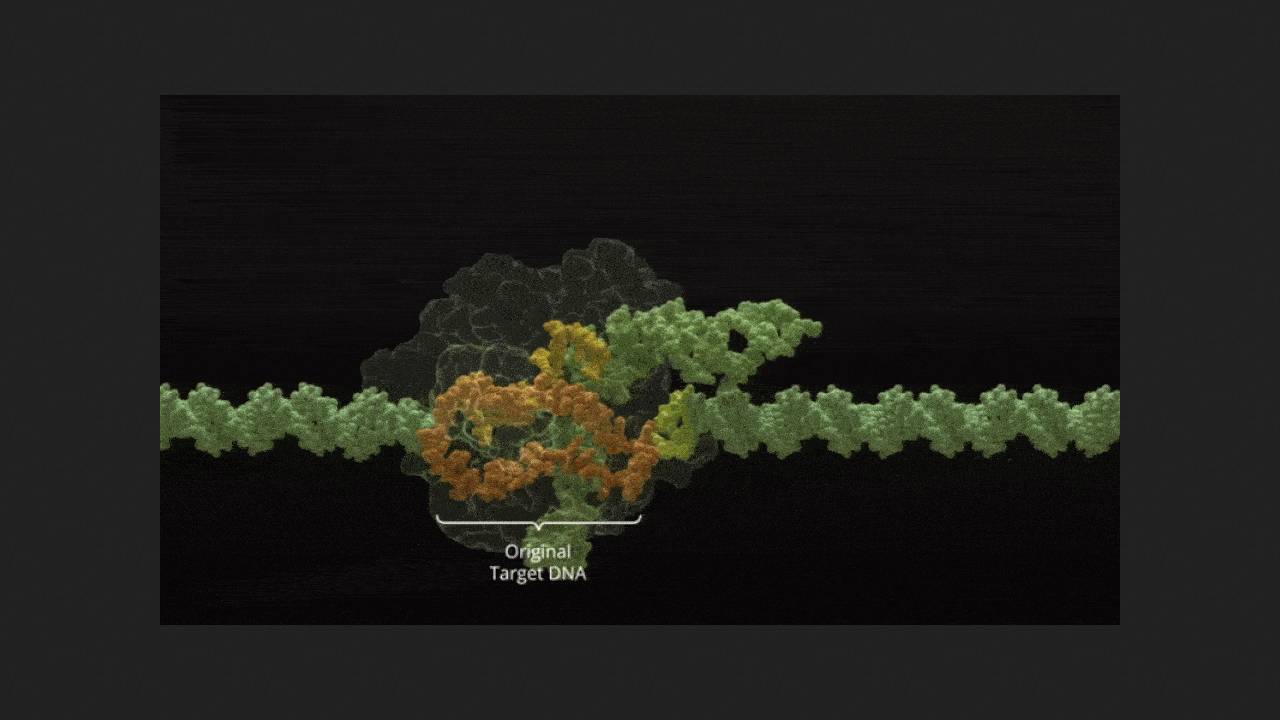
Серповидноклітинна анемія та бета-таласемія пов'язані зі спадковим порушенням синтезу нормального дорослого гемоглобіну А, що призводить до порушення морфології еритроцитів, анемії та інших ускладнень. Ексагамглоген аутотемцел (екса-ціл, exa-cel, CTX001), призначений для лікування обох цих захворювань, став першим у світі схваленим до застосування препаратом на основі технології редагування геному CRISPR-Cas9. При його застосуванні у пацієнта забирають кровотворні стовбурові клітини, в лабораторії вимикають у них ген BCL11A, який блокує вироблення фетального гемоглобіну F у дорослих (в нормі він функціонує у плода), і вводять назад в організм. Там вони дають початок паростку кровотворення, який виробляє еритроцити зі здоровим гемоглобіном F замість дефектного гемоглобіну А. В даний час екса-ціл схвалений до застосування у пацієнтів віком 12 років і більше.
Хайдар Франгул (Haydar Frangoul) з Дослідницького інституту Сари Кеннон з колегами проводять дворічні відкриті нерандомізовані випробування третьої фази за участю дітей 5–11 років із серповидноклітинною анемією та як мінімум двома важкими вазооклюзивними кризами на рік протягом двох років (C11 SCD-1) бета-таласемією та переливанням понад 100 мілілітрів крові на кілограм маси тіла на рік протягом двох років (CLIMB THAL-141). Станом на квітень 2025 року одноразову інфузію екса-целу після мієлоабляції бусульфаном та з подальшою стимуляцією кровотворення отримали 10 дітей (середній вік 8,3 року, порівну хлопчиків і дівчаток) у рамках CLIMB SCD-151 та 13 дітей (середній вік 7,4) THAL-141.
Период наблюдения на момент презентации составил от 3,9 до 23,7 (медианно 8,3) месяца в CLIMB SCD-151 и от 2,2 до 22,7 (медианно 12,6) месяца в CLIMB THAL-141. На тот же момент ни у одного из участников CLIMB SCD-151 после инфузии не было вазооклюзивных кризов при нормальном уровне гемоглобина, и два, за которыми наблюдали не менее 12 месяцев, достигли первичной конечной точки — не имели кризов и не нуждались в стационарном лечении по их поводу в течение всего этого периода. Девять из 13 участников CLIMB THAL-141 жили без переливаний крови, и все пять, за которыми наблюдали не менее 12 месяцев, достигли первичной конечной точки — не нуждались в переливаниях весь этот период. Средний уровень гемоглобина к шести месяцам достиг и превысил 118 (в том числе фетального 110) грамм на литр и оставался стабильным.
У всех участников обоих испытаний наблюдалась стабильная экспрессия отредактированных аллелей в костном мозге и крови. Профиль безопасности в целом соответствовал опыту проведения миелоабляции и аутологичной трансплантации кроветворных стволовых клеток. У единственного пациента в CLIMB THAL-141 развилось редкое, но известное осложнение миелоабляции бусульфаном — тяжелая венооклюзионная болезнь, которая привела к полиорганной недостаточности и смерти. У остальных участников серьезных последствий лечения не наблюдалось.
Предварительные результаты клинических испытаний свидетельствуют, что эффективность и безопасность CRISPR-терапии тяжелых форм серповидноклеточной анемии и бета-талассемии у детей младше 12 лет соответствуют таковым у подростков от 12 лет и взрослых, однократное ее проведение может приводить к стойкому излечению. Окончательные результаты испытаний ожидаются позже, после их завершения участники войдут в когорту долгосрочного (до 15 лет) наблюдения CLIMB-131.
Ранее Франгул с коллегами сообщили, что у пациентов в возрасте 12 лет и старше терапия экса-целом приводит не только к улучшениям клинических характеристик, но и к многоплановому, выраженному и стойкому повышению качества жизни. В настоящее время клинические испытания проходит in vivo CRISPR-терапия наследственного ангионевротического отека, наследственной дегенерации сетчатки, неконтролируемой дислипидемии и форм транстиретинового амилоидоза с полинейропатией и кардиомиопатией, а также редактирование азотистых оснований при наследственной гиперхолестеринемии.