Японським дослідникам вдалося включити хлоропласти червоної водорості у клітини ссавців і поспостерігати у яких фотосинтетичну активність протягом щонайменше двох днів. Звіт про роботу опубліковано в журналі Proceedings of the Japan Academy, Series B.
Перші вказівки на появу фотосинтезу мають вік близько 3,4 мільярди років; прямі його свідчення у вигляді тилакоїдних мембран ціанобактерій – близько 1,8 мільярда років. 1,2-1,6 мільярда років тому ціанобактерії були захоплені еукаріотичними клітинами, що призвело до їх успішного ендосимбіозу, в результаті якого з'явилися хлоропласти рослин. У середині ХХ століття було показано, що ізольовані хлоропласти протягом деякого часу зберігають фотосинтетичну активність, хоча механізми цього недостатньо зрозумілі. Після цього різні наукові групи різними способами намагалися включити ці органели в невластиві їм клітини, але вони зберігали свою морфологію лише кілька годин, і їхня фотосинтетична активність у новому оточенні підтверджена не була.
Сатіхіро Мацунага (Sachihiro Matsunaga) з Токійського університету з колегами виділили хлоропласти з одноклітинної червоної водорості Cyanidioschyzon merolae, яка зберігає примітивні риси і мешкає в гарячих вулканічних джерелах з високою кислотністю води. Її хлоропласти активні при температурі нижче 37 градусів Цельсія, зберігають свою структуру в ізольованому стані та рідко диференціюються в інші пластиди за зміни умов середовища, що робить їх перспективними кандидатами для інкорпорації в інші клітини. Виділені хлоропласти зберігали фонтосинтетичну активність та морфологію навіть через шість днів зберігання при температурі чотири градуси за Цельсієм.
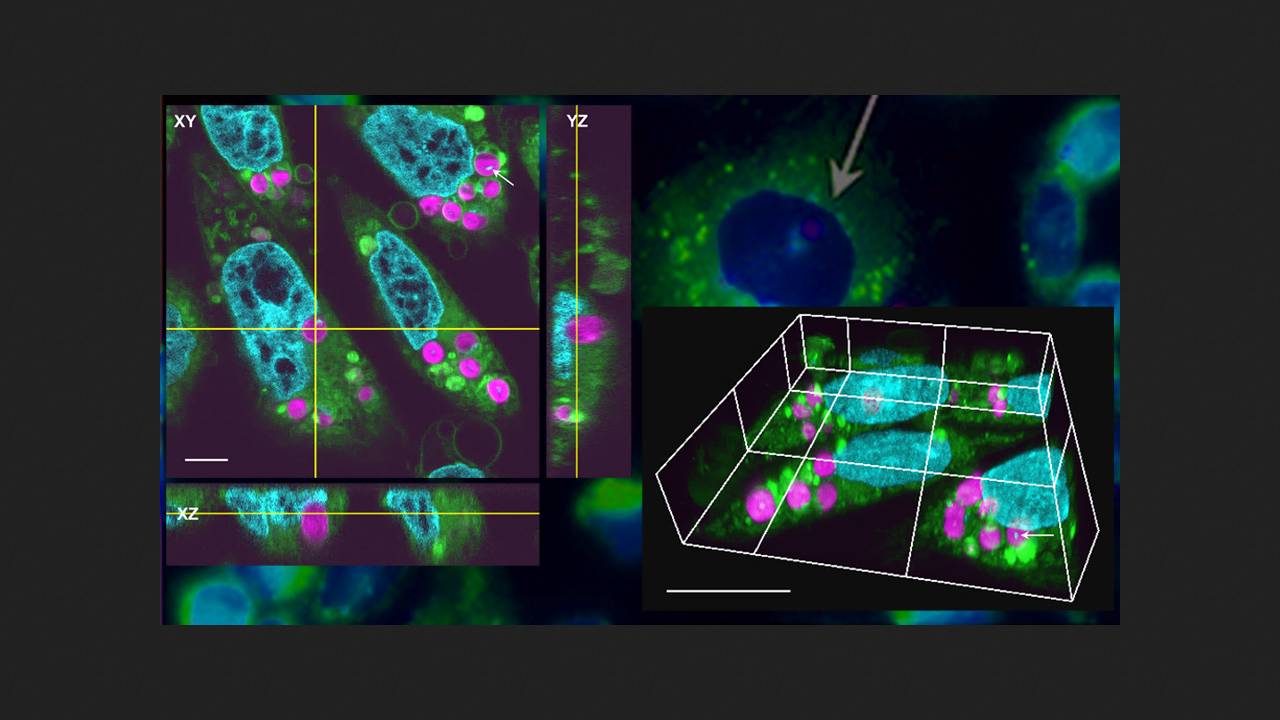
Отримані хлоропласти культивували спільно з клітинами яєчника китайського хом'ячка (Cricetulus griseus) широко застосовуваної в біотехнології імморталізованої лінії CHO-K1 у співвідношенні 100 до 1. У той же день конфокальна мікроскопія показала, що близько 10% клітин (7-45) цих органел. Другого дня клітини з хлоропластами демонстрували вищу швидкість зростання, ніж контрольні. Через два і чотири дні спільної культивації кількість захоплених органел у клітинах знижувалася — ймовірно, або внаслідок їх внутрішньоклітинного перетравлення, або внаслідок випадкового розподілу між дочірніми клітинами в ході поділу.
Хлоропласти розташовувалися у внутрішньоклітинних везикулах циркулярно поблизу ядра, не проникаючи в нього, і були оточені мітохондріями; нативна ДНК у яких зберігалася. Автори роботи використовували флуоресцентну мікроскопію для ідентифікації цих органел за вмістом у них хлорофілу та скануючу електронну мікроскопію для детального вивчення їх мембран. Хлоропласти мали подвійну зовнішню мембрану і множинні шари тилакоїдних мембран. Першого дня спільної культивації в деяких із них ця шарувата структура була інтактною, в інших — частково деформованою. Через два дні у частини хлоропластів збільшилися відстань між тилакоїдними мембранами та розмір пластоглобул (ліпопротеїнових частинок із пластохіноном, що з'являються у відповідь на стрес). Через чотири дні тилакоїдні мембрани деградували.
Для оцінки фотосинтетичної активності – транспорту електронів у фотосистемі II – дослідники скористалися флуориметрією з візуалізаційною амплітудно-імпульсною модуляцією (Imaging-PAM). У перший день і через два дні спільної культивації ця активність у захоплених клітинами хлоропластах значно не відрізнялася від такої в ізольованих органелах, але до четвертого дня суттєво знижувалася.
Таким чином, при правильному доборі хлоропластів та клітин-реципієнтів ці органели можуть зберігати структуру та фотосинтезуючу активність протягом як мінімум двох днів після захоплення. Такий низхідний підхід синтетичною біологією може бути основою отримання штучно фотосинтезирующих тварин клітин, укладають автори роботи.
Раніше китайські дослідники створили наноструктури з тилакоїдами хлоропластів і впровадили їх у хондроцити мишей, які потім пересадили у суглобові хрящі живим тваринам. Їхні італійські колеги змогли зібрати фотосинтетичний апарат у штучній клітці, використавши лише основний трансмембранний білок реакційного центру пурпурових бактерій.