Британські дослідники проаналізували структуру клітинної стінки метицилін-резистентного золотистого стафілокока і дійшли висновку, що гени стійкості дозволяють йому у присутності антибіотиків ділитися альтернативним способом з іншою архітектурою стінки. Звіт про роботу опубліковано в журналі Science, там їй присвячена редакційна стаття.
Після масового застосування бета-лактамного пеніциліну в 1940-50-х роках у золотистого стафілококу (Staphylococcus aureus) почали швидко поширюватися стійкі штами за рахунок вироблення бета-лактамаз. Для боротьби з ними у 1959 році було впроваджено метицилін – похідне пеніциліну, яке не руйнується цим ферментом. Однак уже в наступному десятилітті були зареєстровані інфекції, викликані метицилін-резистентним золотистим стафілококом (MRSA), і в даний час він є однією з найбільш небезпечних антибіотикостійких бактерій, що забирає понад 100 тисяч життів на рік.
Бета-лактамні антибіотики діють, блокуючи пеніцилінзв'язуючі білки (PBP) - ферменти, що відповідають за складання пептидогліканів клітинної стінки бактерій. У золотистого стафілокока їх чотири, але тільки PBP1 і PBP2 є критичні для побудови клітинної стінки. MRSA володіє невластивим його видом варіантом PBP2a з низькою афінністю до більшості бета-лактамів, який отриманий від інших видів стафілококу, кодується геном mecA і горизонтально переноситься генетичними касетами SCCmec різних типів. Він може виконувати транспептидажні функції PBP2, але не PBP1. Таке пристосування забезпечує захист від невисоких концентрацій метициліну, проте приблизно в одній з 10 тисяч клітин MRSA стійкість вкрай висока за рахунок додаткових мутацій в генах потенціювання (pot), в тому числі кодують субодиниці РНК-полімерази (rpo *), і в присутності антибіотика ці клітини піддаються.
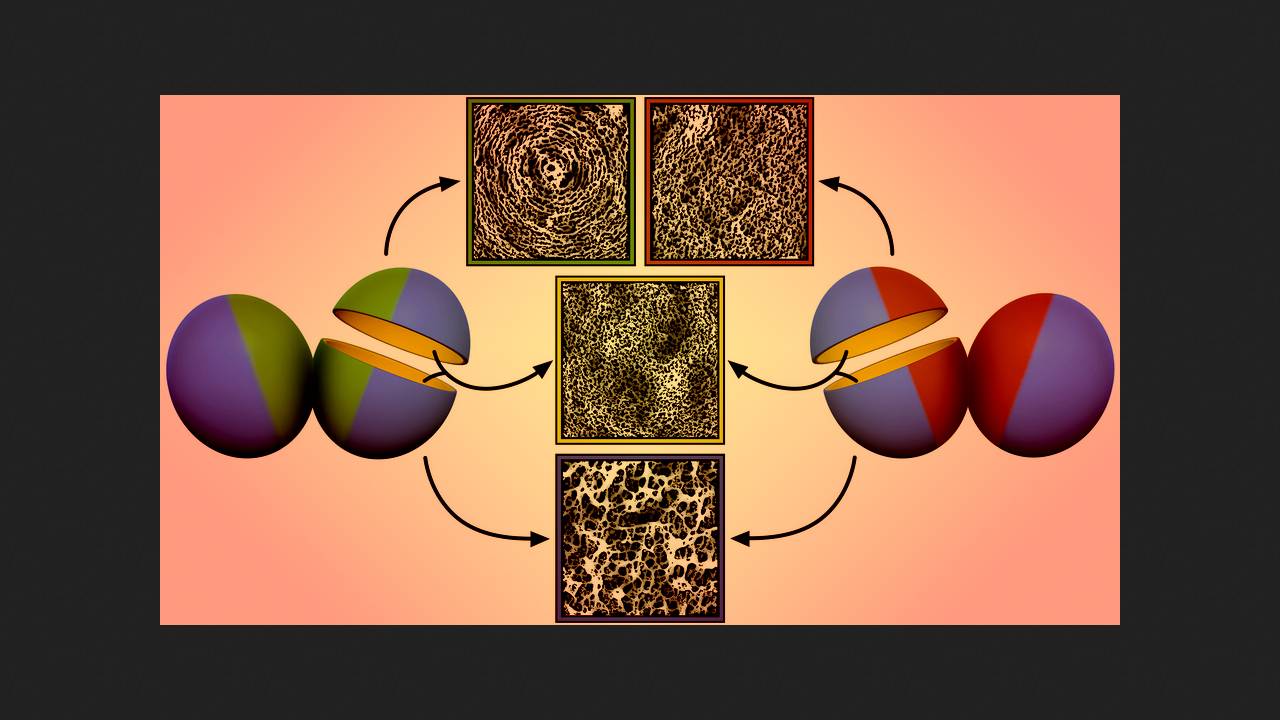
Саймон Фостер (Simon Foster) з Шеффілдського університету з колегами скористалися атомно-силовою мікроскопією (АСМ) високої роздільної здатності, щоб дослідити структуру клітинної стінки антибіотикочутливого штаму золотистого стафілокока (MSSA) і того ж штаму, з геном mecA (тобто. У відсутність антибіотиків у обох бактерій пептидоглікани зовнішньої поверхні мали крупноячеистую сітчасту структуру з великими порами, а з внутрішньої, де вони синтезуються, формували значно щільнішу мережу. При утворенні нової стінки, що служить перегородкою дочірніх клітин при розподілі, її зовнішні пептидоглікани складалися в характерні концентричні кола.
Под действием 1,5 микрограмма метициллина на миллилитр среды, что немного меньше минимальной подавляющей концентрации (МПК) для обычного MRSA, в стенке MSSA появлялись крупные отверстия и клетка погибала. У mecA+ MRSA в этих условиях в перегородке между клетками наружные пептидогликаны не формировали концентрическую структуру, а представляли собой плотную однородную сеть, при этом толщина стенки снижалась. Такая же утрата концентрических окружностей с формированием плотной сети наблюдалась у высокоустойчивого штамма MRSA, несущего мутацию rpoB* помимо гена mecA, при концентрации антибиотика 25 микрограмм на миллилитр (смертельной для MSSA и mecA+ MRSA), однако у него стенка утолщалась с образованием дополнительной выпуклости посередине. Аналогичные паттерны формирования стенки в присутствии антибиотика демонстрировали различные клинически значимые высокоустойчивые штаммы MRSA с разными типами SCCmec.
Выяснив это, авторы работы, экспериментируя с различными штаммами золотистого стафилококка, провели систематическое исследование молекулярных механизмов обычного (в отсутствие антибиотиков) и альтернативного (в их присутствии у устойчивых штаммов) способов деления клеток. Они выяснили, что за рост концентрических структур пептидогликанов в процессе деления отвечает только чувствительный к метициллину PBP1. Мутация rpoB может компенсировать траспептидазную активность этого белка, и именно она отвечает за формирование плотной сети пептидогликанов. В комбинации с замещением активности PBP2 устойчивым PBP2a это исключает необходимость в чувствительных PBP1 и PBP2, обеспечивая альтернативный способ деления и высокую резистентность к метициллину. Аналогично мутантному rpoB может действовать pot мутация гена rel, который отвечает за стрессовую реакцию бактерий на дефицит нутриентов, и обе этих мутации повышают концентрацию в клетке алармона гуанозинтетрафосфата.
В завершение авторы работы показали, что некоторые соединения могут вернуть MRSA чувствительность к метициллину в культуре при определенных мутациях: кломифен и спермин — при mecA+ pbp2* и mecA+ pbp2* rpoB*, но не pbp1* rpoB*; норгестимат — pbp1* rpoB* и mecA+ pbp2*, но не mecA+ pbp2* rpoB*, эпикатехина галлат — при всех трех. Имеет ли это клиническое значение, а также используют ли другие бактерии альтернативный синтез клеточной стенки при делении в присутствии антибиотиков, предстоит выяснить в дальнейших исследованиях.
Ранее было показано, что кожа людей может противостоять проникновению MRSA за счет выработки интерлейкина-8, из-за чего он может быть комменсалом в кожной микробиоте, а гаплонедостаточность гена OTULIN, напротив, предрасполагает к тяжелым стафилококковым инфекциям. При этом бета-лактамный цефалоспорин пятого поколения цефтобипрол пока сохраняет активность в отношении MRSA.