Американские ученые сообщили об открытии новой популяции нейронов-мишеней для гормона жировой ткани лептина. Ими оказались нейроны дугообразного ядра гипоталамуса, экспрессирующие базонуклин 2. Под воздействием лептина эти нейроны напрямую ингибируют AgRP-нейроны и тем самым подавляют аппетит у мышей. Исследование опубликовано в журнале Nature.
Вырабатываемый жировой тканью лептин поддерживает гомеостатический контроль массы жировой ткани путем регуляции потребления пищи и энергетического баланса. Это происходит за счет ингибирования AgRP-нейронов и нейронов, экспрессирующих нейропептид Y, а также активации нейронов, экспрессирующих гипоталамический проопиомеланокортин (POMC-нейроны). Все эти нейроны находятся в дугообразном ядре гипоталамуса.
В целом, две популяции нейронов — AgRP-нейроны и POMC-нейроны — антагонистически регулируют потребление пищи, опосредованное лептином. Однако функциональные эффекты и динамика процессов этих нейронов различаются в нескольких важных аспектах, и ряд данных указывает на существование других нейронных популяций, чувствительных к лептину, которые могут иметь решающее значение для управляемого лептином контроля потребления пищи и массы тела.
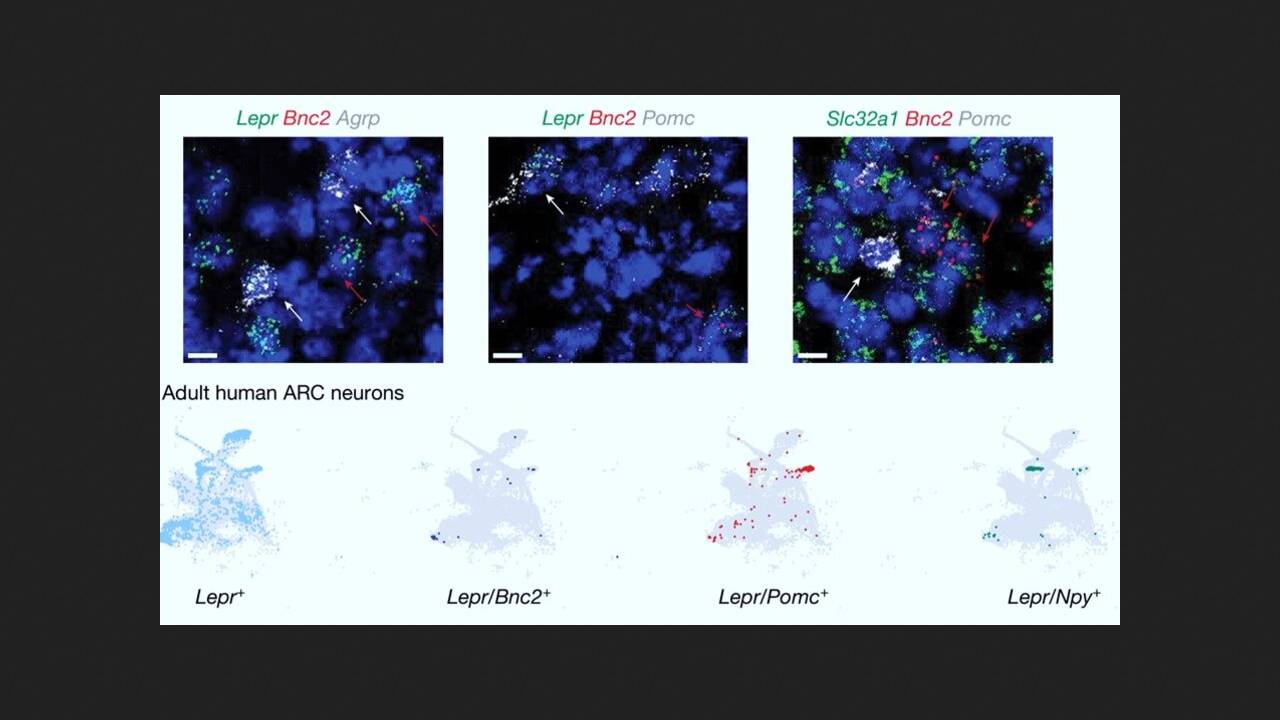
Исследователи под руководством Джеффри Фридмана (Jeffrey Friedman) из Рокфеллеровского университета провели систематическое профилирование транскриптомов нейронов дугообразного ядра гипоталамуса мышей с использованием одноядерного РНК-секвенирования. Выяснилось, что в одном из кластеров присутствуют ранее не описанные нейроны, экспрессирующие рецептор лептина. Ими оказались нейроны, экспрессирующие базонуклин 2 (BNC2-нейроны) — белок семейства базонуклин-цинковых пальцев, который участвует в регуляции сплайсинга мРНК, процессинга, транскрипции и играет важную роль в раннем эмбриональном развитии.
Для дальнейшего изучения динамики и функционирования BNC2-нейронов ученые вывели линию мышей с нокаутом гена BNC2. Эксперименты показали, что BNC2-нейроны реагируют на сенсорные сигналы, связанные с едой, в зависимости от опыта, и что потребление пищи еще больше активизирует эти нейроны. В эксперименте мышам, которые голодали в течение ночи, на две или десять минут давали пищу. После того как еду убирали, активность BNC2-нейронов быстро снижалась, и, напротив, она оставалась высокой при постоянном доступе к пищи.
Дальнейшие молекулярные исследования показали, что часть сенсорных сигналов, которые подавляют AgRP-нейроны и снижают аппетит после приема пищи, передаются BNC2-нейронами. Затем несколько опытов продемонстрировали, что лептин повышает активность BNC2-нейронов. Они, в свою очередь, напрямую ингибируют активность AgRP-нейронов, что приводит к подавлению аппетита.
Удаление рецепторов лептина в BNC2-нейронах вызывало чрезмерное повышение аппетита и приводило к ожирению у мышей. Подобные изменения наблюдались и при нокауте генов рецепторов лептина в AgRP-нейронах. Примечательно, что ученые также наблюдали улучшение толерантности к глюкозе и повышение чувствительности к инсулину у мышей после активации BNC2-нейронов.
Таким образом, ученые приходят к выводу, что популяция BNC2-нейронов в дугообразном ядре гипоталамуса непосредственно и быстро регулирует питание и энергетический баланс. Эти результаты добавляют новый важный компонент в нейронную цепь, ответственную за аппетит и его нарушения, и добавляют знаний о механизмах, с помощью которых лептин регулирует эту систему. Потенциально, фармакологическая активация этих нейронов может иметь терапевтическое значение для снижения веса.
Ранее мы рассказывали, что вкус и запах еды индуцирует фрагментацию митохондрий в печени через активацию POMC-нейронов.