Химики из США смоделировали и экспрессировали в бактериях белки, связывающихся с порфириновыми комплексами железа, и использовали их для каталитического циклопропанирования двойных связей и внедрения диазосоединений в связи кремний-углерод. В обоих случаях, пишут химики в Science, смоделированные de novo катализаторы оказались эффективными без применения направленной эволюции.
Реакции циклопропанирования и внедрения в связи элемент-водород можно проводить с помощью металлоорганических катализаторов. Обычно в таком катализаторе металл связан с хиральным лигандом, за счет которого продукт реакции образуется в виде одного оптического изомера. При таком подходе подобрать подходящий лиганд бывает сложно, и химикам приходится перебирать много разных катализаторов в поисках самого эффективного.
Еще один подход к асимметрическому катализу — это связывание металлоорганических катализаторов с белками. В этом случае вместо хиральных лигандов за селективность отвечает структура белка. Если структура активного центра подобрана правильно, то аминокислотные остатки будут «направлять» реакцию в активном центре так, чтобы получился только один оптический изомер продукта. При этом если такой белковый катализатор работает недостаточно хорошо, его структуру можно оптимизировать с помощью направленной эволюции. О том, как она работает, мы рассказывали в тексте «Игра в Бога».
Именно второй подход недавно применили химики под руководством Уильяма ДеГрадо (William F. DeGrado) из Калифорнийского университета в Сан-Франциско. Их идея была в том, чтобы смоделировать белковые катализаторы для реакций циклопропанирования алкенов и внедрения в связи кремний-водород.
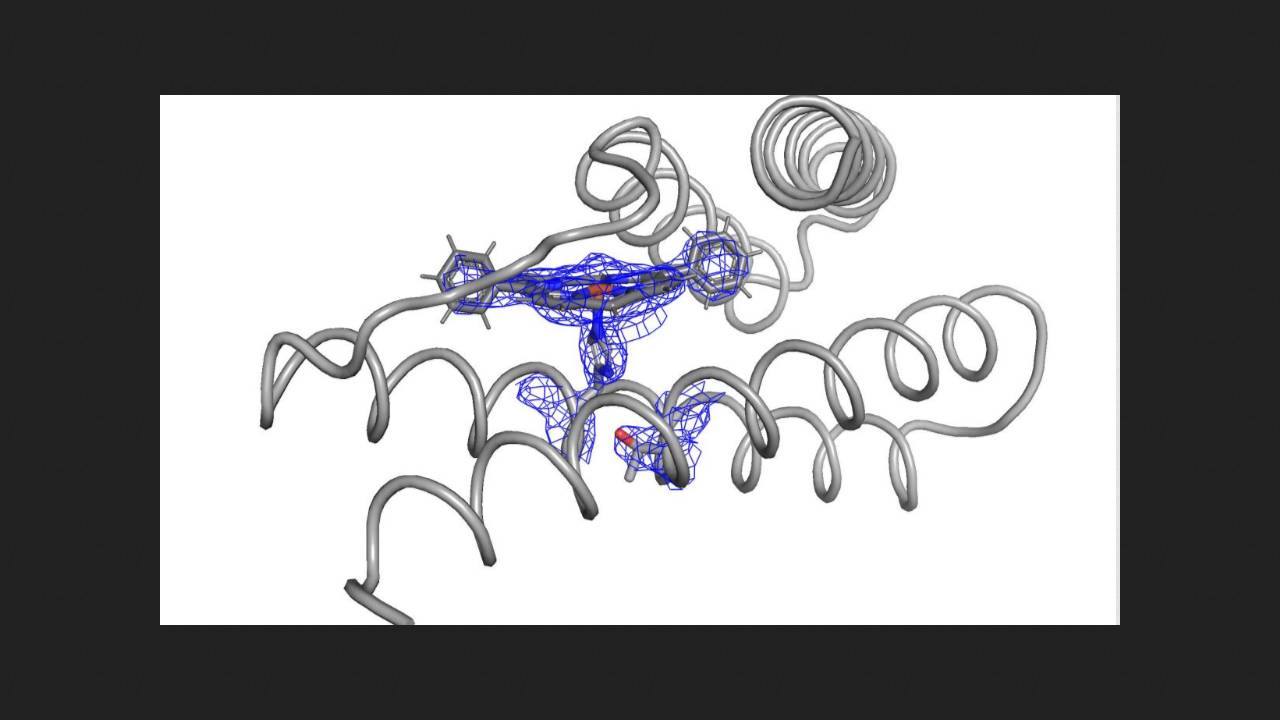
Сначала химики взяли уже известный каталитически активный белок с дифенилпорфириновым кофактором (он образует комплекс с ионом железа), и протестировали его в реакции циклопропанирования стирола этилдиазоацетатом. Продукт получился с выходом и энантиомерным избытком в 40 процентов. Тогда ученые предположили, что структура белка не позволяет реагентам легко проникать в активный центр, и из-за этого выход невысокий.
Чтобы смоделировать на основе этого белка более эффективные катализаторы, ученые использовали несколько алгоритмов машинного обучения, в том числе ранее разработанный в их лаборатории. В результате они получили набор из нескольких десятков структур белков, из которых выбрали десять с наиболее определенной структурой активного центра, и экспрессировали их в бактериях. Большинство полученных белков оказались эффективными катализаторами циклопропанирования стирола. Лучший полученный результат — количественный выход продукта и энантиомерный избыток около 99 процентов.
Далее химики таким же способом смоделировали структуры белков для катализа реакции внедрения диазосоединений в связь кремний-водород. Но в этот раз вместо дифенилпорфиринового кофактора они выбрали протопорфирин IX, который выступает предшественником гема в клетках. Выбранные белки химики снова экспрессировали в бактериях, и они оказались эффективными катализаторами. Кроме того, ученым удалось дополнительно повысить энантиоселективность внедрения с помощью направленной эволюции полученных катализаторов в живых клетках. Это сработало благодаря тому, что ученые выбрали клеточный метаболит протопорфирин IX в качестве кофактора.
Так химикам удалось получить набор белковых катализаторов для двух реакций. Но несмотря на высокую эффективность полученных катализаторов, небольшие изменения в структуре исходных веществ часто приводили к падению выхода и энантиоселективности.
Ранее мы рассказывали о том, как химики использовали липазу дрожжей в комбинации с рутенивевым катализатором для энантиоселективного синтеза макроциклов.