Химики из Германии научились вводить анилины в реакцию кросс-сочетания с бороновыми кислотами. При этом анилины промежуточно превращались в диазониевые соли, которые окислительно присоединялись к палладиевому катализатору. Исследование опубликовано в Angewandte Chemie International Edition.
В классическом кросс-сочетании по Судзуки бороновая кислота и арилгалогенид реагируют с образованием связи углерод-углерод в присутствии палладиевого катализатора. Вместо арилгалогенидов в эту реакцию можно вводить анилины, но для этого сначала их надо превращать в неустойчивые и иногда взрывчатые диазониевые соли.
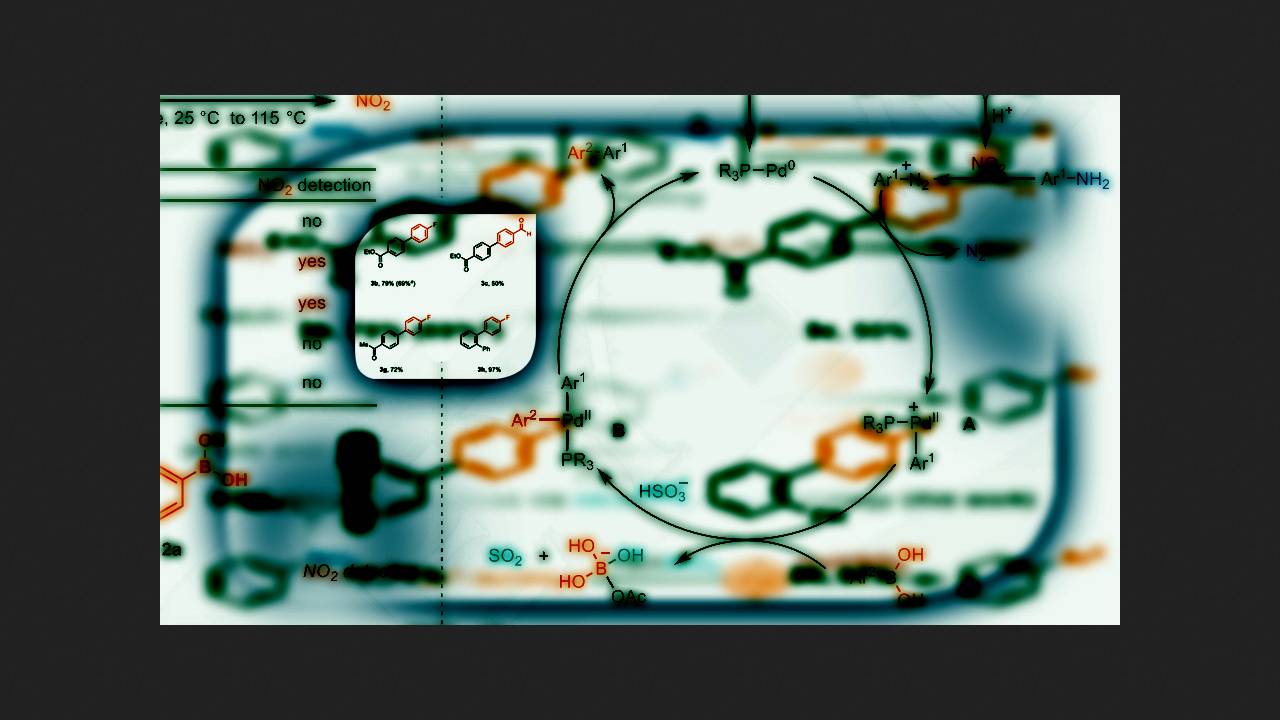
Чтобы преодолеть эту проблему, химики под руководством Тобиаса Риттера (Tobias Ritter) из Института исследования угля Общества Макса Планка решили применить недавно разработанный ими метод генерации диазониевых солей из анилинов с помощью нитратов. Ранее они использовали этот метод для получения ароматических галогенпроизводных из анилинов, и он оказался безопаснее классического диазотирования, потому что диазониевые соли не накапливалось в реакционной смеси.
Из тех же соображений химики решили применить этот метод для реакции Судзуки с анилинами. Сначала они смешивали 4-фторбороновую кислоту и 4-метиланилин в присутствии разных палладиевых катализаторов, нитрата трет-бутиламмония и других добавок. В результате оказалось, что реакция протекает с выходом 69 процентов, если в качестве восстановителя использовать гидросульфит натрия NaHSO3. В своей предыдущей работе ученые использовали тиосульфат натрия Na2S2O3, но, как они предполагают, он слишком прочно связывается с палладиевым катализатором, и реакция Судзуки в его присутствии практически не идет.
Подобранные условия реакции химики протестировали на разных анилинах и бороновых кислотах. Оказалось, что их условия позволяют использовать не только анилины, но и аминогетероциклы. Кроме того, за счет быстрого окислительного присоединения диазосоединений, реакция шла селективно даже в присутствии ароматических бромпроизводных. Главный недостаток этой реакции, как отмечают авторы статьи, это низкие выходы продуктов при использовании бороновых кислот с донорными заместителями в ароматическом кольце.
Таким образом, химики разработали общий метод синтеза биарильных производных из анилинов и бороновых кислот. При этом для генерации диазосоединений они использовали более безопасный нитратный метод, а большинство продуктов получились с выходами от 40 процентов.
Недавно мы рассказывали о том, как ученые использовали катализатор на основе железа, а не палладия, для проведения реакции Судзуки.