Российские ученые нашли в терапевтическом фаговом коктейле для лечения бактериальных инфекций неизвестный ранее бактериофаг Sxt1, способный инфицировать ряд диких штаммов кишечной палочки, устойчивых к фагам из того же семейства. Сравнив Sxt1 с родственными фагами Т3 и Т7, ученые обнаружили, что секрет его эффективности кроется в строении хвостовых фибрилл. Результаты исследования опубликованы в журнале Viruses.
Одним из решений проблемы резистентности бактерий к антибиотиками является лечение бактериальных инфекций при помощи бактериофагов — вирусов, заражающих бактерии. Но фаги узкоспецифичны и могут инфицировать только определенные штаммы одного вида бактерий, поэтому в терапии используют фаговые коктейли — смеси разных фагов, обладающих активностью в отношении разных штаммов одного или нескольких видов бактерий. Однако из-за отсутствия данных о клинической эффективности терапевтических фаговых коктейлей их применение ограничено.
Группа ученых из Лаборатории анализа метагеномов из Сколтеха под руководством Артема Исаева (Artem Isaev) изучила состав терапевтического фагового коктейля «Секстафаг (пиобактериофаг поливалентный)», выпускаемого российской компанией «Микроген», и выделила новый бактериофаг Sxt1, который оказался способен заражать целый ряд штаммов E. coli, в том числе и некоторые из них, стойкие к другим, родственным ему фагам.
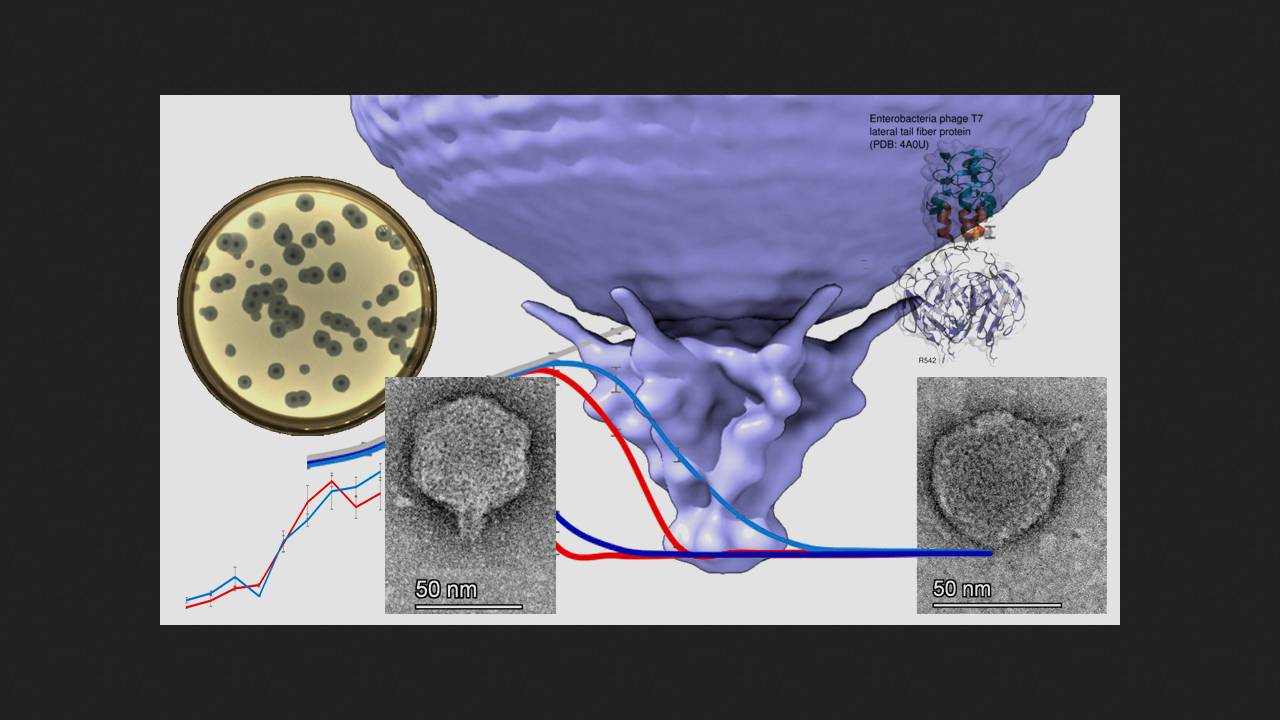
Полифаговый коктейль «Секстафаг» содержит фаги, выделенные из бактерий Staphylococcus spp., Streptococcus spp., Proteus (Р. vulgaris, P. mirabilis), P. aeruginosa, Klebsiella pneumoniae и энтеропатогенной E. coli. В ходе исследования ученые использовали в качестве хозяина штамм E. coli BW25113. Из коктейля был выделен фаг Sxt1 из семейства Autographiviridae, оказавшийся близким родственником фагов кишечной палочки Т3 и Т7. У фагов из этого семейства имеется РНК-полимераза, которая транскрибирует ряд генов фага. Предранние гены (гены, транскрибируемые сразу после заражения бактериальной клетки) Sxt1, ранние (задействованные в метаболизме ДНК и репликации генома фага), а также часть поздних генов (кодируют структурные компоненты вирионов фага, его упаковки и лизис бактерии) были практически полностью идентичны генам фага Т3. Отличия Sxt1 от родственных фагов обнаружены в генах, кодирующих хвостовые фибриллы и два внутренних белка, и являются, по мнению ученых, результатом рекомбинации фагов, предположительно с фагом Berlinvirus.
Исследователи построили филогенетическое древо бактериофагов подсемейства Studiervirinae, куда входит Sxt1, определили его предполагаемое происхождение и пришли к выводу, что секрет его исключительности кроется именно в белке латеральных хвостовых фибрилл. Фаги из семейства Autographiviridae для прикрепления к бактериальной клетке используют шесть хвостовых фибрилл, каждая из которых состоит из тримера этого белка. На концах тримера имеются участки, контактирующие с поверхностью клетки. N-концевой домен необходим для прикрепления к капсиду, длинный пирамидальный домен включает в себя бета-листы от каждой из трех молекул, входящих в состав тримера, за ним расположен короткий альфа-спиральный линкер и концевой домен, отвечающий за взаимодействие с бактериальной клеткой. Пирамидальный домен Sxt1 содержал шесть вставок длиной более пяти аминокислот, причем некоторые из вставок образовывали дополнительные бета-слои. Линкер также включал в себя дополнительную вставку из 27 аминокислот. В итоге за счет вставок хвостовая фибрилла Sxt1 длиннее, чем у Т3 и Т7. С помощью программы AlphaFold2 ученым удалось смоделировать концевой домен Sxt1 с альфа-спиральным линкером и часть пирамидального, и оказалось, что она только на 43 процента идентична аналогичной области фага Т3 и на 54 процента — фага Т7. При этом хвостовые фибриллы Sxt1 распознают иной набор рецепторов бактериальной клетки по сравнению с Т3 и Т7.
Для оценки специфичности нового фага исследователи высеяли фаги Sxt1, T7 и T3 на распространенные штаммы E. coli: BW25113, MG1655, BL-21, B, C, DH5α, HS и Nissle1917, а также на штаммы F+ BW39773 и KD263, которые способны ингибировать T7 из-за наличия системы абортивной инфекции PifA. Устойчивыми ко всем фагам оказались только штаммы HS и Nissle1917. Все остальные штаммы E. coli фаг Sxt1 успешно инфицировал. При этом Т3 не смог заразить штаммы линии К12, а Т7 потерпел неудачу со штаммами с системой PifA.
Для определения спектра хозяев фага Sxt1 ученые проверили, как он взаимодействует с разными штаммами кишечной палочки. Бактерии E. coli делятся на серогруппы по строению О-антигена — полисахарида на внешней мембране клеточной стенки, отличающегося высокой вариабельностью и позволяющего бактериям избегать защитного действия адаптивного иммунитета. Исследователи предполагают, что О-антигены — одно из основных препятствий для распознавания бактерии фагами. То есть, чем выше специфичность фага к О-антигенам бактерий, тем более эффективен он для фаговой терапии. Исследователи использовали коллекцию ECOR — набор природных изолятов E. coli с расходящимися типами О-антигенов и проверили, как на разные штаммы действуют фаги Sxt1, T3 и T7. Фаг Sxt1 смог инфицировать 15 из 72 штаммов коллекции (20 процентов), включая всех бактерий, восприимчивых к T7 и/или T3, и еще 7 штаммов, устойчивых к этим фагам. Тогда исследователи проанализировали действие фага на штамм ECOR50, который чувствителен к Sxt1, но не к T7 или T3, и оказалось, что только Sxt1 способен связываться с его поверхностью. То есть, причина эффективности Sxt1 кроется в его умении распознавать рецепторы бактерии, а не в повышенной устойчивости к защитным системам клетки.
Ученые пришли к выводу, что фаг Sxt1 с расширенным спектром хозяев эффективнее своих родственников — фагов Т3 и Т7. Он имеет большой потенциал для терапевтического применения при инфекциях, вызванных E. coli, а оценка его специфичности могла бы стать стандартной процедурой для характеристики бактериофагов.
В последние годы в свете борьбы с антибиотикорезистентностью ведется активный поиск новых бактериофагов, а также разработка методов их модификации. В 2021 году американские ученые встроили в бактериофаг систему CRISPR/Cas9, что позволило нацелить его на конкретный штамм кишечной палочки. В том же году португальские ученые создали синтетические бактериофаги, поражающие синегнойную палочку.