Китайские и американские исследователи сообщили об успешном эксперименте по лечению тяжелой системной склеродермии у пациентки готовым препаратом NK-лимфоцитов с химерным антигенным рецептором, полученных из донорских индуцированных плюрипотентных стволовых клеток. Отчет опубликован в Cell.
Технология химерных антигенных рецепторов (о ней можно почитать в материале «Химера против рака») изначально разрабатывалась для модификации Т-лимфоцитов при лечении опухолей. Наибольшие успехи в ее применении достигнуты при В-клеточных онкозаболеваниях, поскольку у В-лимфоцитов есть высокоспецифичные антигены CD19 и BCMA, представляющие хорошую мишень для CAR-Т-терапии. Также в клинических испытаниях схожий подход успешно применяли для терапии различных аутоиммунных заболеваний (редакция журнала Science, как и Nature, назвала эти эксперименты одним из основных научных достижений 2024 года), поскольку в их патогенезе ключевую роль играют В-клетки. Все эти схемы лечения требуют выделения аутологичных Т-лимфоцитов из крови пациента, внедрения в них трансгена CAR на вирусном векторе в лаборатории, размножения и введения обратно в организм. При этом у большинства пациентов после инфузии CAR-Т-лимфоцитов развиваются типичные осложнения: синдром выброса цитокинов, нейротоксический синдром ICANS или гипервоспалительный синдром IEC-HS разной степени тяжести.
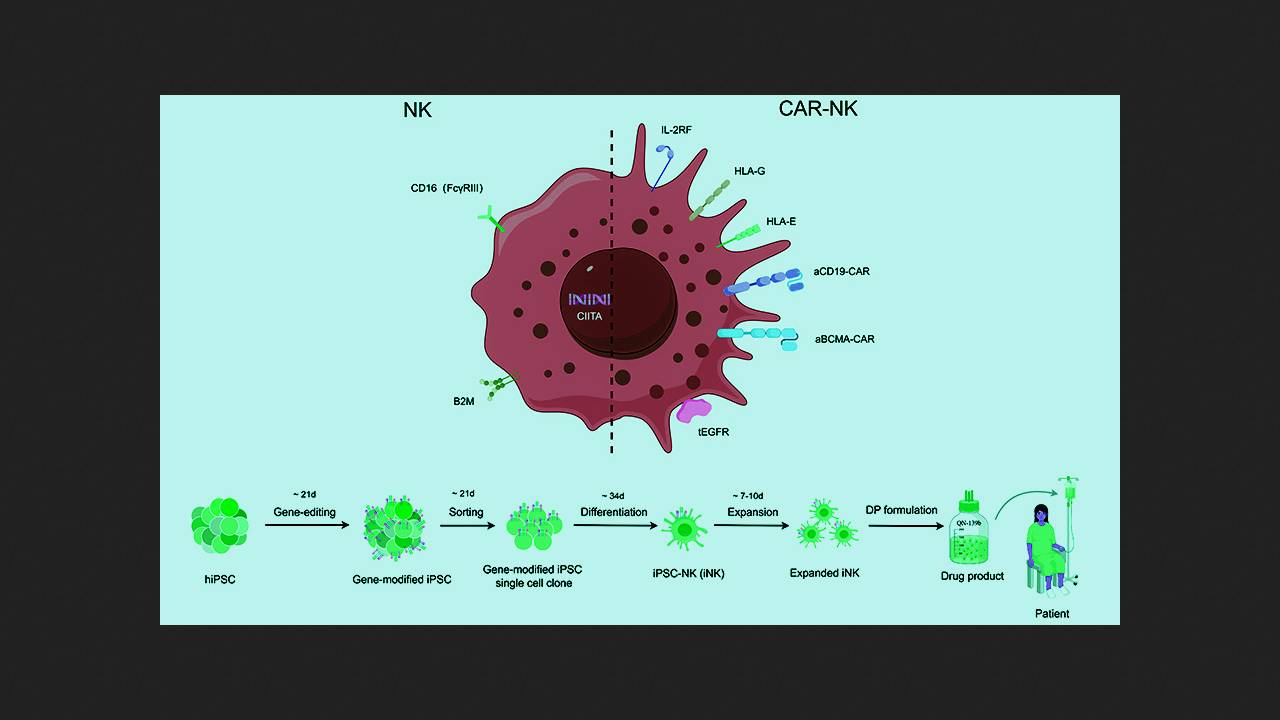
В ходе доклинических и пилотных клинических испытаний использование NK-лимфоцитов с химерным антигенным рецептором (CAR-NK-лимфоцитов) показывало значительно меньшую токсичность и потенциально более высокую эффективность по сравнению с CAR-T-лимфоцитами при лечении В-клеточных. Хуцзи Сюй (Huji Xu) из Военно-морского медицинского университета и Университета Цинхуа с коллегами и сотрудниками компании Qihangene Biotech решили испытать CAR-NK-клетки при тяжелом, устойчивом к терапии аутоиммунном заболевании, причем использовать для их изготовления NK-лимфоциты, полученные из донорских индуцированных плюрипотентных стволовых клеток (ИПСК). Такой подход призван упростить, удешевить и стандартизовать процедуру, а также предоставить пациенту готовый препарат без времени ожидания.
При создании экспериментального препарата QN-139b исследователи генетически донорские ИПСК с помощью редактора цитозиновых оснований для нокаута генов и системы CRISPR/Cas9 для сайт-специфичной интеграции желаемых модификаций. Успешно модифицированные клетки клонировали в культуре и дифференцировали в NK-лимфоциты. Внесенные модификации включали нокаут компонент главного комплекса гистосовместимости B2M и CIITA для предотвращения распознавания Т-клетками реципиента, а также нокаут мембранного иммуноглобулина CD16 и нокин человеческих лимфоцитарных антигенов (HLA) G и E для минимизации активации NK-клетками пациента. Кроме того, в клетки внесли конструкты, экспрессирующие рецепторы интерлейкина-2 (IL-2RF) для усиления активации и персистирования и рецептор эпидермального фактора роста (tEGFR) в качестве «аварийного выключателя» анти-EGFR антителами. Полученные клетки снабдили двумя типами CAR, нацеленными на CD19 и BCMA, отобрали успешно модифицированные, оценили их проточной цитометрией и анализом на функциональные маркеры и испытали на клеточных культурах и мышах.
Для участия в клиническом эксперименте авторы работы пригласили 36-летнюю женщину с тяжелой диффузной кожной системной склеродермией. В 16 лет у нее выявили синдром Рейно и высокий уровень (+++) специфичных для заболевания анти-Scl-70 антител. К 18 годам появились утолщения кожи конечностей, прогрессирующая эритема и боль в суставах, со временем кожные проявления распространились на лицо, шею и грудную клетку. За три года до поступления у женщины выявили интерстициальное поражение легких, непосредственно перед ним — умеренный фиброз миокарда с сохранной фракцией выброса. Многолетняя терапия метилпреднизолоном, циклофосфамидом, гидроксихлорохином, метотрексатом, микофенолата мофетилом, тоцилизумабом и нидабусиба этансульфонатом прогрессирование заболевания не остановила.
После лимфодеплеции пациентке провели четыре внутривенных инфузии 600 миллионов клеток QN-139b с интервалом в три дня. Пиковая концентрация CAR-NK-клеток (270 на миллилитр крови) и их доля в общем числе лимфоцитов (2,74 процента) наблюдались на седьмой день от первой инфузии и вернулись почти на исходный уровень к двенадцатому. Сразу после инфузии произошло резкое снижение уровня периферических В-лимфоцитов, который начал восстанавливаться через два месяца и продолжал через полгода, причем с преобладанием наивных В-клеток (что свидетельствует о перезагрузке иммунной системы). Также на фоне лимфодеплеции резко снизились уровни Т- и NK-лимфоцитов, которые начали восстанавливаться через две недели и продолжали через полгода. В течение шести месяцев наблюдались прогрессирующее снижение уровней аутоантител анти-Scl-70 и анти-SSA/Ro52, нормализация уровней компонент системы комплемента C3 и C4, стабильный уровень иммуноглобулина G, существенное снижение уровней иммуноглобулинов А и М и нормализация уровня иммуноглобулина Е (до лечения в разы повышенного).
Клинически наблюдалось уменьшение проявлений заболевания по шкале EUSTAR-AI с 3,68 до 1,33 балла к шестому месяцу; по трем или более из пяти пунктов шкалы CRISS улучшение составило не менее 20 процентов к первому месяцу, 30 процентов — ко второму и 50 процентов — к третьему. Регрессия кожного фиброза, отека и эритемы наблюдалась визуально, ультрасонографически, эластографически и гистологически; фиброз легких также значимо уменьшился, миокарда — практически разрешился. Состояние микроциркуляторного русла при капилляроскопии стало значительно лучше с признаками роста новых сосудов. Количественный протеомный анализ крови выявил повышенную экспрессию белков, связанных с ангиогенезом, подавлением пролиферации соединительной ткани, реакцией на окислительный стресс и иммуносупрессией, и сниженную — с активацией иммунитета, воспалением и фиброзом. Существенных побочных реакций на терапию выявлено не было, уровень маркера воспаления С-реактивного белка колебался в пределах нормальных значений, температура тела не повышалась.
Результаты пилотного клинического эксперимента показывают, что CAR-NK-лимфоциты из донорских стволовых клеток можно рассматривать в качестве перспективного метода терапии тяжелых аутоиммунных заболеваний, устойчивых к принятым схемам терапии.
В начале 2025 года американские исследователи сообщили об успехе первых клинических испытаний готового препарата CAR-NK-лимфоцитов из донорских ИПСК (FT596), в которых приняли участие 86 пациентов с рефрактерной или рецидивирующей В-клеточной лимфомой.