Испанские исследователи выполнили мультиомный анализ отдельных клеток в инфузионном продукте терапевтических Т-лимфоцитов с химерными антигенными рецепторами и обнаружили, что состав и свойства клеток в нем, а также их динамика после введения значительно влияют на эффективность лечения. Отчет о работе опубликован в журнале Cell Reports Medicine.
Т-лимфоциты с химерными антигенными рецепторами (CAR-T-лимфоциты) позволяют добиваться радикальных успехов в терапии онкозаболеваний, вплоть до полного излечения (подробно об этой технологии можно почитать в материале «Химера против рака»). В настоящее время до клинического использования дошли препараты для лечения B-клеточных онкогематологических новообразований и одной из разновидностей синовиальной саркомы. При этом они эффективно помогают примерно половине пациентов, у которых не сработали другие виды терапии, а у другой половины ответ недостаточен или отсутствует. Вероятность успеха зависит от множества факторов, изучение которых продолжается в настоящее время.
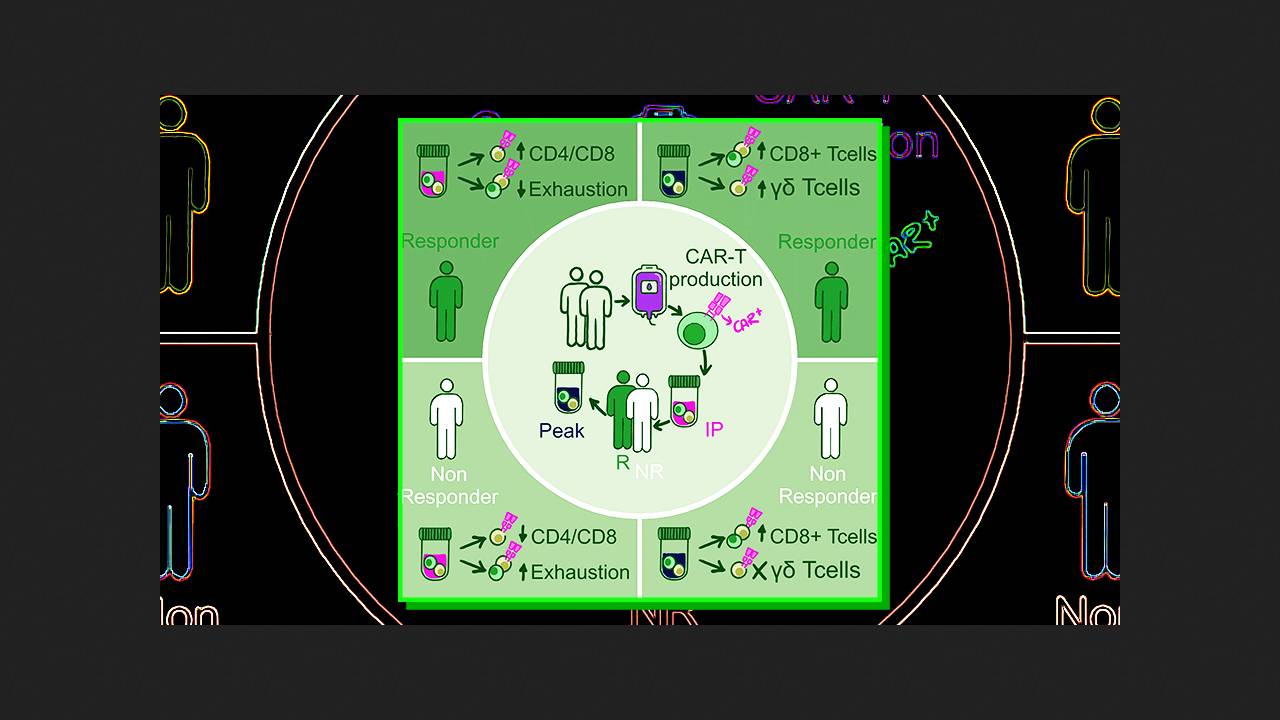
Пабло Менендес (Pablo Menéndez) из Исследовательского института лейкемии имени Жозепа Каррераса с коллегами провел интегральный анализ клональной кинетики и транскриптомной гетерогенности инфузионных продуктов CD19-CAR-T-лимфоцитов (варнимкабтагена аутолейцела, варни-цела), изготовленных ex vivo для пяти пациентов с рефрактериным или рецидивирующим острым B-клеточным лимфобластным лейкозом. Для этого они выполнили секвенирование αβ T-клеточного рецептора и РНК в отдельных клетках, выделенных проточной цитометрией по принципу экспрессии CAR. В анализ клеточной динамики вошли и трансдуцированные CAR (CAR-положительные), и нетрансдуцированные (CAR-отрицательные) Т-лимфоциты продукта.
Уровень трансдукции CAR в инфузионных продуктах составил от 23 до 38 процентов. Уровни размножения CAR-T-лимфоцитов в организме пациентов были различными, достигая пика между перовой и четвертой неделями после инфузии. У двух пациентов наблюдался ранний рецидив на втором и третьем месяце, у одного — поздний на шестом, у двух был получен стойкий полный ответ на терапию. В общей сумме во всех образцах на разных стадиях были проанализированы 37,1 тысячи одиночных высококачественных Т-лимфоцитов. В них четко выделялись кластеры наивных CD4+-клеток; эффекторных, запоминающих и цитотоксических CD8+-клеток, а также цитотоксических γδ Т-клеток.
Сопоставление подтипов CAR-положительных и CAR-отрицательных клеток в инфузионном продукте показало, что первые пролиферируют значительно активнее, а среди непролиферирующей фракции вторых наблюдается значительно большая доля эффекторных CD8+-клеток. Как выяснилось, у пациентов с полным ответом на терапию CAR-положительных CD4+-клеток в инфузионном продукте было как минимум втрое больше, чем CD8+. Влияние этого соотношения на эффективность было подтверждено (p = 0,03) в отдельной когорте из 47 пациентов с острым B-клеточным лимфобластным лейкозом. При этом экспрессия маркеров истощения Т-лимфоцитов, предшествующего трансдукции, отрицательно коррелировала с успешностью терапии.
На пике размножения в организме пациентов доля пролиферирующих CAR-положительных и CAR-отрицательных Т-лимфоцитов снижалась, замещаясь CD8+-клетками, они же преобладали над CD4+ среди непролиферирующих CAR-положительных. При этом популяция и положительных, и отрицательных γδ Т-лимфоцитов на пике значительно возрастала, и ее рост прямо коррелировал с эффективностью терапии. Клиническое значение этих клеток было подтверждено в ретроспективных когортах из 18 пациентов с острым B-клеточным лимфобластным лейкозом, получавших варни-цел, и 58 пациентов с диффузной крупно-B-клеточной лимфомой, получавших акси-цел или тиса-цел.
Полученные результаты указывают на сложный характер Т-клеточного ответа при CD19-CAR-T-терапии, который не ограничен только CAR-положительными αβ Т-лимфоцитами. В частности, большое значение имеет отношение CD4+/CD8+-клеток в инфузионном продукте, предшествующее истощение клеток и размножение γδ Т-лимфоцитов после инфузии. Влияние на эти факторы может в перспективе повысить успешность лечения, заключают авторы работы.
Ранее американские исследователи смогли в доклинических испытаниях на мышах многократно повысить эффективность CAR-T-терапии, используя для этого экспериментальный модифицированный человеческий интерлейкин-7, который стимулирует рост лимфоцитов.