Researchers from seven countries presented preliminary results from a Phase III clinical trial of ex vivo CRISPR therapy for severe forms of sickle cell anemia and beta thalassemia in children under 12 years of age. The drug's efficacy in the first few patients reached 100 percent, with good tolerability. The report was presented at the 67th annual meeting of the American Society of Hematology (ASH 2025).
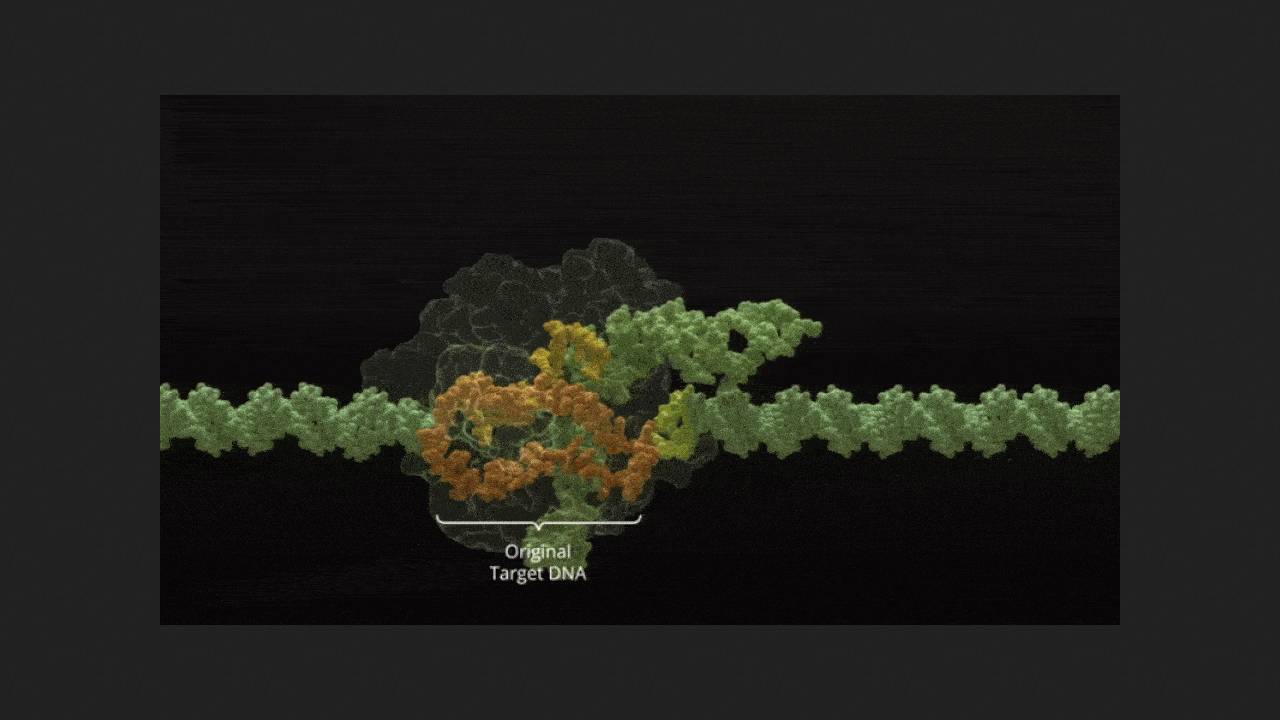
Sickle cell anemia and beta-thalassemia are inherited disorders that disrupt the normal production of adult hemoglobin A, leading to abnormal red blood cell morphology, anemia, and other complications. Exagamglogen autotemcel (exa-cel, CTX001), designed to treat both of these conditions, has become the world's first approved treatment based on CRISPR-Cas9 genome editing technology. It involves harvesting hematopoietic stem cells from a patient, knocking out the BCL11A gene, which blocks the production of fetal hemoglobin F in adults (which normally functions in fetuses), and reintroducing them into the body. There, they give rise to a hematopoietic lineage that produces red blood cells with healthy hemoglobin F instead of defective hemoglobin A. Exa-cel is currently approved for use in patients 12 years of age and older.
Haydar Frangoul of the Sarah Cannon Research Institute and colleagues are conducting a two-year, open-label, non-randomized phase III trial in children aged 5-11 years with sickle cell disease and at least two severe vaso-occlusive crises per year for two years (CLIMB SCD-151) and children aged 2-11 years with beta-thalassemia and transfusions of more than 100 milliliters of blood per kilogram of body weight per year for two years (CLIMB THAL-141). As of April 2025, 10 children (mean age 8.3 years, 50/50 boys) in CLIMB SCD-151 and 13 children (mean age 7.4 years, 61.5 percent boys) in CLIMB THAL-141 have received a single infusion of Exacel following myeloablation with busulfan and subsequent hematopoiesis stimulation.
Период наблюдения на момент презентации составил от 3,9 до 23,7 (медианно 8,3) месяца в CLIMB SCD-151 и от 2,2 до 22,7 (медианно 12,6) месяца в CLIMB THAL-141. На тот же момент ни у одного из участников CLIMB SCD-151 после инфузии не было вазооклюзивных кризов при нормальном уровне гемоглобина, и два, за которыми наблюдали не менее 12 месяцев, достигли первичной конечной точки — не имели кризов и не нуждались в стационарном лечении по их поводу в течение всего этого периода. Девять из 13 участников CLIMB THAL-141 жили без переливаний крови, и все пять, за которыми наблюдали не менее 12 месяцев, достигли первичной конечной точки — не нуждались в переливаниях весь этот период. Средний уровень гемоглобина к шести месяцам достиг и превысил 118 (в том числе фетального 110) грамм на литр и оставался стабильным.
У всех участников обоих испытаний наблюдалась стабильная экспрессия отредактированных аллелей в костном мозге и крови. Профиль безопасности в целом соответствовал опыту проведения миелоабляции и аутологичной трансплантации кроветворных стволовых клеток. У единственного пациента в CLIMB THAL-141 развилось редкое, но известное осложнение миелоабляции бусульфаном — тяжелая венооклюзионная болезнь, которая привела к полиорганной недостаточности и смерти. У остальных участников серьезных последствий лечения не наблюдалось.
Предварительные результаты клинических испытаний свидетельствуют, что эффективность и безопасность CRISPR-терапии тяжелых форм серповидноклеточной анемии и бета-талассемии у детей младше 12 лет соответствуют таковым у подростков от 12 лет и взрослых, однократное ее проведение может приводить к стойкому излечению. Окончательные результаты испытаний ожидаются позже, после их завершения участники войдут в когорту долгосрочного (до 15 лет) наблюдения CLIMB-131.
Ранее Франгул с коллегами сообщили, что у пациентов в возрасте 12 лет и старше терапия экса-целом приводит не только к улучшениям клинических характеристик, но и к многоплановому, выраженному и стойкому повышению качества жизни. В настоящее время клинические испытания проходит in vivo CRISPR-терапия наследственного ангионевротического отека, наследственной дегенерации сетчатки, неконтролируемой дислипидемии и форм транстиретинового амилоидоза с полинейропатией и кардиомиопатией, а также редактирование азотистых оснований при наследственной гиперхолестеринемии.