British researchers analyzed the cell wall structure of methicillin-resistant Staphylococcus aureus and concluded that resistance genes allow it to divide in the presence of antibiotics using an alternative cell wall architecture. A report on the study was published in the journal Science, along with an editorial dedicated to it.
Following the widespread use of beta-lactam penicillin in the 1940s and 1950s, resistant strains of Staphylococcus aureus began to rapidly spread due to the production of beta-lactamases. To combat these, methicillin—a penicillin derivative that is not destroyed by this enzyme—was introduced in 1959. However, in the following decade, infections caused by methicillin-resistant Staphylococcus aureus (MRSA) were recorded, and it currently represents one of the most dangerous antibiotic-resistant bacteria, claiming over 100,000 lives annually.
Beta-lactam antibiotics act by blocking penicillin-binding proteins (PBPs), enzymes responsible for assembling bacterial cell wall peptides. Staphylococcus aureus has four of these, but only PBP1 and PBP2 are critical for cell wall construction. MRSA possesses a species-unusual variant of PBP2a with low affinity for most beta-lactams. It is derived from other Staphylococcus species, encoded by the mecA gene, and horizontally transferred by SCCmec gene cassettes of various types. It can perform the transpeptidase functions of PBP2, but not PBP1. This adaptation provides protection against low concentrations of methicillin, but approximately one in 10,000 MRSA cells exhibits extremely high resistance due to additional mutations in potentiating genes (pot), including those encoding RNA polymerase subunits (rpo*). In the presence of the antibiotic, these cells undergo positive selection.
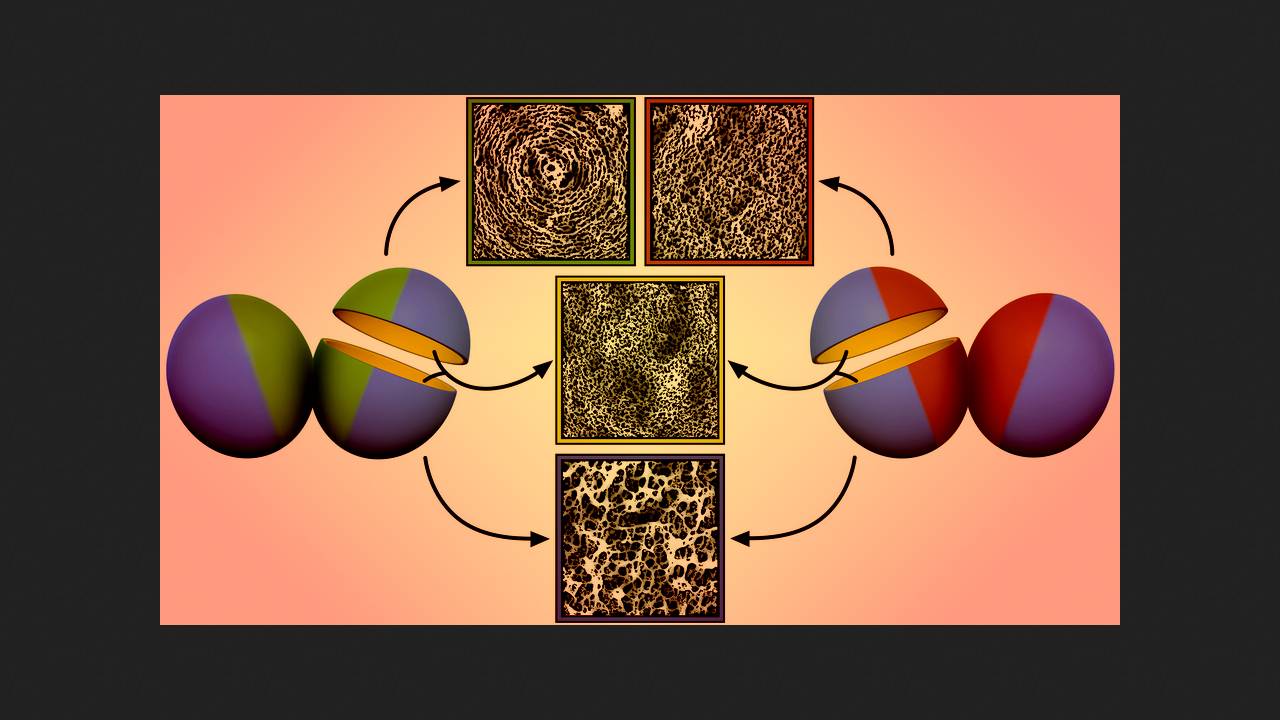
Simon Foster of the University of Sheffield and colleagues used high-resolution atomic force microscopy (AFM) to examine the cell wall structure of an antibiotic-sensitive strain of Staphylococcus aureus (MSSA) and the same strain equipped with the mecA gene (i.e., MRSA). In the absence of antibiotics, the peptidoglycans of both bacteria on the outer surface had a coarse mesh structure with large pores, while on the inner surface, where they are synthesized, they formed a much denser network. As a new wall formed, serving as a barrier between daughter cells during division, its outer peptidoglycans folded into characteristic concentric circles.
Под действием 1,5 микрограмма метициллина на миллилитр среды, что немного меньше минимальной подавляющей концентрации (МПК) для обычного MRSA, в стенке MSSA появлялись крупные отверстия и клетка погибала. У mecA+ MRSA в этих условиях в перегородке между клетками наружные пептидогликаны не формировали концентрическую структуру, а представляли собой плотную однородную сеть, при этом толщина стенки снижалась. Такая же утрата концентрических окружностей с формированием плотной сети наблюдалась у высокоустойчивого штамма MRSA, несущего мутацию rpoB* помимо гена mecA, при концентрации антибиотика 25 микрограмм на миллилитр (смертельной для MSSA и mecA+ MRSA), однако у него стенка утолщалась с образованием дополнительной выпуклости посередине. Аналогичные паттерны формирования стенки в присутствии антибиотика демонстрировали различные клинически значимые высокоустойчивые штаммы MRSA с разными типами SCCmec.
Выяснив это, авторы работы, экспериментируя с различными штаммами золотистого стафилококка, провели систематическое исследование молекулярных механизмов обычного (в отсутствие антибиотиков) и альтернативного (в их присутствии у устойчивых штаммов) способов деления клеток. Они выяснили, что за рост концентрических структур пептидогликанов в процессе деления отвечает только чувствительный к метициллину PBP1. Мутация rpoB может компенсировать траспептидазную активность этого белка, и именно она отвечает за формирование плотной сети пептидогликанов. В комбинации с замещением активности PBP2 устойчивым PBP2a это исключает необходимость в чувствительных PBP1 и PBP2, обеспечивая альтернативный способ деления и высокую резистентность к метициллину. Аналогично мутантному rpoB может действовать pot мутация гена rel, который отвечает за стрессовую реакцию бактерий на дефицит нутриентов, и обе этих мутации повышают концентрацию в клетке алармона гуанозинтетрафосфата.
В завершение авторы работы показали, что некоторые соединения могут вернуть MRSA чувствительность к метициллину в культуре при определенных мутациях: кломифен и спермин — при mecA+ pbp2* и mecA+ pbp2* rpoB*, но не pbp1* rpoB*; норгестимат — pbp1* rpoB* и mecA+ pbp2*, но не mecA+ pbp2* rpoB*, эпикатехина галлат — при всех трех. Имеет ли это клиническое значение, а также используют ли другие бактерии альтернативный синтез клеточной стенки при делении в присутствии антибиотиков, предстоит выяснить в дальнейших исследованиях.
Ранее было показано, что кожа людей может противостоять проникновению MRSA за счет выработки интерлейкина-8, из-за чего он может быть комменсалом в кожной микробиоте, а гаплонедостаточность гена OTULIN, напротив, предрасполагает к тяжелым стафилококковым инфекциям. При этом бета-лактамный цефалоспорин пятого поколения цефтобипрол пока сохраняет активность в отношении MRSA.