Rosyjscy naukowcy odkryli w terapeutycznym koktajlu fagowym do leczenia infekcji bakteryjnych nieznanego wcześniej bakteriofaga Sxt1, zdolnego do infekowania wielu dzikich szczepów Escherichia coli opornych na fagi z tej samej rodziny. Porównując Sxt1 z pokrewnymi fagami T3 i T7, naukowcy odkryli, że sekret jego skuteczności tkwi w strukturze włókienek ogonkowych. Wyniki badań opublikowano w czasopiśmie „Viruses”.
Jednym z rozwiązań problemu oporności bakterii na antybiotyki jest leczenie zakażeń bakteryjnych za pomocą bakteriofagów – wirusów infekujących bakterie. Jednak fagi są wysoce specyficzne i mogą infekować tylko określone szczepy jednego rodzaju bakterii, dlatego w terapii stosuje się koktajle fagowe – mieszaniny różnych fagów, które wykazują aktywność przeciwko różnym szczepom jednego lub kilku rodzajów bakterii. Jednak ze względu na brak danych dotyczących skuteczności klinicznej terapeutycznych koktajli fagowych, ich zastosowanie jest ograniczone.
Grupa naukowców z Laboratorium Analizy Metagenomu Skoltech pod kierownictwem Artema Isajewa zbadała skład terapeutycznego koktajlu fagowego „Sekstafag (poliwalentny piobakteriofag)” produkowanego przez rosyjską firmę „Mikrogen” i wyizolowała nowego bakteriofaga Sxt1, który okazał się zdolny do zakażania wielu szczepów E. coli, w tym niektórych opornych na inne spokrewnione fagi.
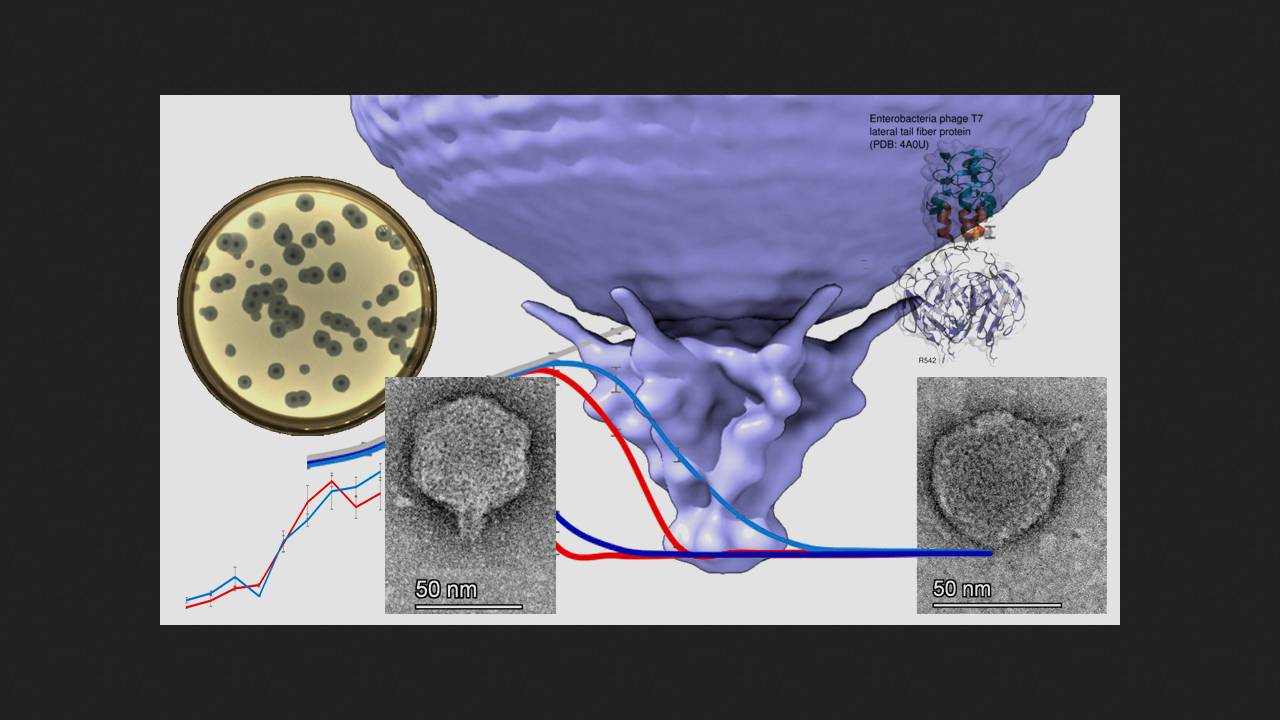
Koktajl polifagowy „Sextaphage” zawiera fagi wyizolowane z bakterii Staphylococcus spp., Streptococcus spp., Proteus (P. vulgaris, P. mirabilis), P. aeruginosa, Klebsiella pneumoniae oraz enteropatogennej E. coli. W trakcie badań naukowcy wykorzystali jako gospodarza szczepy E. coli BW25113. Z koktajlu wyizolowano faga Sxt1 z rodziny Autographiviridae, który okazał się bliskim krewnym fagów Escherichia coli T3 i T7. Fagi z tej rodziny posiadają polimerazę RNA, która transkrybuje szereg genów fagowych. Wczesne geny (geny transkrybowane bezpośrednio po infekcji komórki bakteryjnej) Sxt1, wczesne geny (zaangażowane w metabolizm DNA i replikację genomu faga), a także część późnych genów (kodujących strukturalne składniki wirionów fagowych, pakowanie ego i lizę bakterii) były niemal identyczne z genami faga T3. Różnice między Sxt1 a pokrewnymi fagami występują w genach kodujących włókienka ogonkowe oraz dwa białka wewnętrzne i, według naukowców, są wynikiem rekombinacji faga, prawdopodobnie z fagiem Berlinvirus.
Исследователи построили филогенетическое древо бактериофагов подсемейства Studiervirinae, куда входит Sxt1, определили его предполагаемое происхождение и пришли к выводу, что секрет его исключительности кроется именно в белке латеральных хвостовых фибрилл. Фаги из семейства Autographiviridae для прикрепления к бактериальной клетке используют шесть хвостовых фибрилл, каждая из которых состоит из тримера этого белка. На концах тримера имеются участки, контактирующие с поверхностью клетки. N-концевой домен необходим для прикрепления к капсиду, длинный пирамидальный домен включает в себя бета-листы от каждой из трех молекул, входящих в состав тримера, за ним расположен короткий альфа-спиральный линкер и концевой домен, отвечающий за взаимодействие с бактериальной клеткой. Пирамидальный домен Sxt1 содержал шесть вставок длиной более пяти аминокислот, причем некоторые из вставок образовывали дополнительные бета-слои. Линкер также включал в себя дополнительную вставку из 27 аминокислот. В итоге за счет вставок хвостовая фибрилла Sxt1 длиннее, чем у Т3 и Т7. С помощью программы AlphaFold2 ученым удалось смоделировать концевой домен Sxt1 с альфа-спиральным линкером и часть пирамидального, и оказалось, что она только на 43 процента идентична аналогичной области фага Т3 и на 54 процента — фага Т7. При этом хвостовые фибриллы Sxt1 распознают иной набор рецепторов бактериальной клетки по сравнению с Т3 и Т7.
Для оценки специфичности нового фага исследователи высеяли фаги Sxt1, T7 и T3 на распространенные штаммы E. coli: BW25113, MG1655, BL-21, B, C, DH5α, HS и Nissle1917, а также на штаммы F+ BW39773 и KD263, которые способны ингибировать T7 из-за наличия системы абортивной инфекции PifA. Устойчивыми ко всем фагам оказались только штаммы HS и Nissle1917. Все остальные штаммы E. coli фаг Sxt1 успешно инфицировал. При этом Т3 не смог заразить штаммы линии К12, а Т7 потерпел неудачу со штаммами с системой PifA.
Aby określić zakres gospodarzy faga Sxt1, naukowcy sprawdzili, jak oddziałuje on z różnymi szczepami Escherichia coli. Bakterie E. coli są podzielone na serogrupy na podstawie struktury antygenu O, polisacharydu na zewnętrznej błonie ściany komórkowej, który jest wysoce zmienny i pozwala bakteriom uniknąć ochronnego działania odporności adaptacyjnej. Naukowcy zakładają, że antygeny O są jedną z głównych przeszkód w rozpoznawaniu bakterii przez fagi. Oznacza to, że im wyższa specyficzność faga wobec antygenów O bakterii, tym skuteczniejsza jest terapia fagowa. Naukowcy wykorzystali kolekcję ECOR - zestaw naturalnych izolatów E. coli z różnymi typami antygenów O i sprawdzili, jak fagi Sxt1, T3 i T7 działają na różne szczepy. Fag Sxt1 był w stanie zainfekować 15 z 72 szczepów z kolekcji (20%), w tym wszystkie bakterie wrażliwe na T7 i/lub T3 oraz 7 szczepów opornych na te fagi. Następnie naukowcy przeanalizowali działanie faga na szczep ECOR50, który jest wrażliwy na Sxt1, ale nie na T7 ani T3, i okazało się, że tylko Sxt1 jest w stanie wiązać się z jego powierzchnią. Oznacza to, że skuteczność Sxt1 leży w jego zdolności do rozpoznawania receptorów bakteryjnych, a nie w zwiększonej odporności na systemy obronne komórki.
Naukowcy doszli do wniosku, że fag Sxt1 o rozszerzonym zasięgu żywicieli jest skuteczniejszy niż jego krewni – fagi T3 i T7. Ma on duży potencjał terapeutyczny w zakażeniach wywołanych przez E. coli, a ocena jego specyficzności może stać się standardową procedurą charakteryzacji bakteriofagów.
W ostatnich latach, w walce z opornością na antybiotyki, prowadzono aktywne poszukiwania nowych bakteriofagów oraz opracowywano metody ich modyfikacji. W 2021 roku amerykańscy naukowcy wbudowali system CRISPR/Cas9 w bakteriofaga, co pozwoliło mu na namierzanie konkretnego szczepu E. coli. W tym samym roku portugalscy naukowcy stworzyli syntetyczne bakteriofagi atakujące Pseudomonas aeruginosa.