American researchers have developed a pharmacologically active hydrogel for the prevention of postoperative adhesions. In experiments on pigs, it effectively prevented the development of adhesions after intestinal surgery without disrupting healing or causing systemic toxicity. A report on the study was published in the journal Science Translational Medicine.
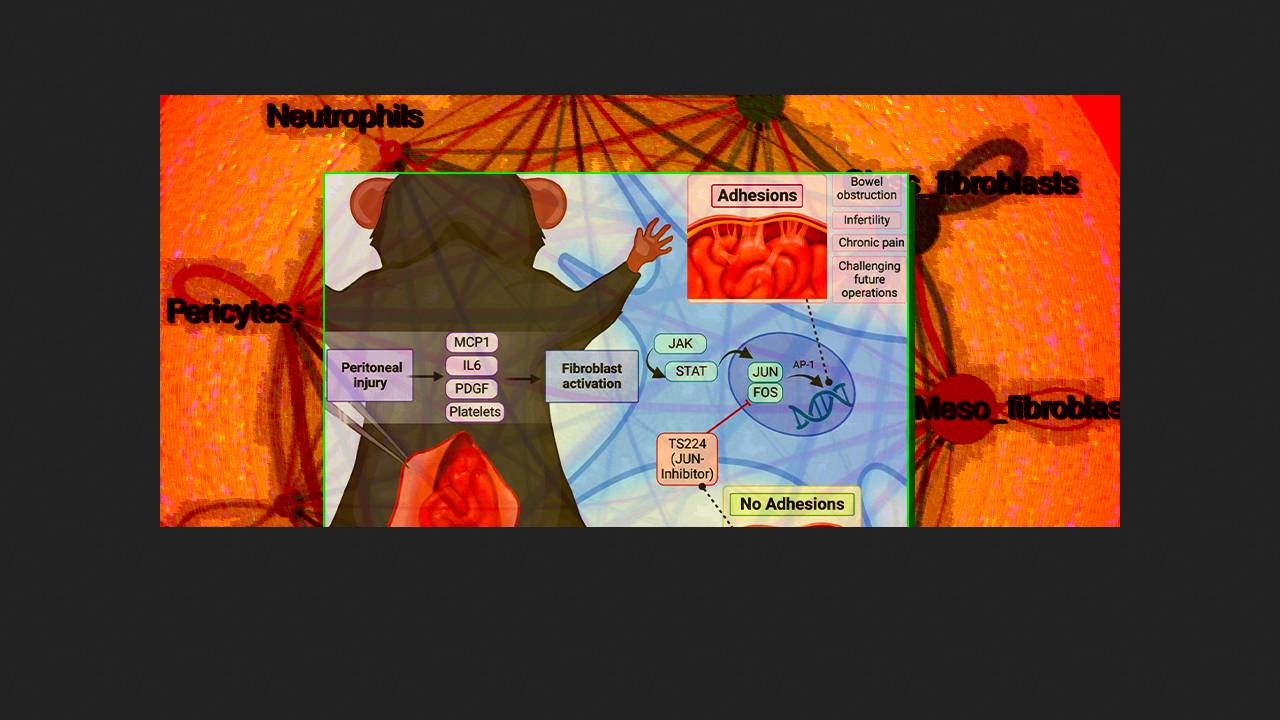
Adhesions form after 50–90 percent of abdominal surgeries, are the primary cause of intestinal obstruction, can cause chronic pain and infertility, and complicate subsequent surgeries. In addition to discomfort and a reduced quality of life, they place an additional burden on the healthcare system and lead to significant financial costs. There are currently no proven methods for preventing or treating adhesions, largely due to a lack of understanding of the mechanisms of their formation and the pathogenesis of adhesions.
In 2020, a team of Stanford University researchers led by Michael Longaker presented the results of a fundamental analysis of adhesion tissues in mice and humans. According to their data, adhesions are formed primarily from the visceral peritoneum as a result of the polyclonal proliferation of tissue fibroblasts, which synthesize scar tissue that anchors intra-abdominal structures and immobilizes the intestine. The primary regulator of this process (adhesion genesis) is the transcription factor Jun, which, together with the protein Fos, forms the AP-1 complex and initiates proliferation and extracellular matrix synthesis. A small-molecule inhibitor of the AP-1 complex, T-5224, suppressed postoperative Jun expression and limited adhesion formation in mice.
To translate these findings into clinical practice, in a new study, Longaker and colleagues embedded T-5224 in a hydroxypropyl methylcellulose hydrogel with modified hydrophobic side chains and cross-linked them with biocompatible micelles of the detergent Tween. The barrier properties of this material synergize with the pharmacological action of T-5224, and its consistency allows for application to the peritoneum at the surgical site using a syringe or spray. Experiments confirmed that the hydrogel has optimal rheological properties and, at millimolar concentrations, sustained release of the active drug for 14 days—a clinically critical time for adhesion formation.
После успешных испытаний гидрогеля на мышах исследователи приступили к опытам на минипигах, устройство желудочно-кишечного тракта и развитие спаечной болезни у которых близко к человеческим. Для этого они разработали и проверили модель спайкообразования, включающую лапаротомию по средней линии, ревизию брюшной полости, резекцию тонкой кишки с ручным наложением анастомоза, скарификацию брюшины правой боковой стенки, промывание изотоническим солевым раствором и ушивание брюшной стенки. Замещение в этой модели солевого раствора на гидрогель с T-5224 приводило к значительно меньшему образованию спаек при ревизии через четыре недели как макроскопически, так и гистологически (в обоих случаях p < 0,0001), причем сформировавшиеся волокна матрикса в присутствии гидрогеля были менее зрелыми и плотными. Анализы показали, что T-5224 хорошо всасывался клетками местно, а его концентрация в крови была низкой и уменьшалась со временем. Признаков гематологической, печеночной и почечной токсичности, влияния на массу тела, а также гистологических изменений внутренних органов выявлено не было. На заживление кишечных анастомозов (в том числе при высокожировой диете) и их механические свойства, а также на регенерацию поврежденной кожи внутрибрюшинное введение гидрогеля значимо не влияло. Секвенирование отдельных клеток спаечной ткани показало, что использование активного препарата подавляло сигнальный путь Jun, причем эффекты этого были значительно более выраженными в мезотелиальных фибробластах, способствующих формированию фиброзных рубцов, чем в ремоделирующих фибробластах, предположительно отвечающих за регенерацию тканей после операции. Таким образом, гидрогель с T-5224 стойко препятствует образованию послеоперационных спаек брюшины без негативного влияния на состояние кишечного анастомоза и заживление брюшной стенки, а также без признаков системной токсичности. Учитывая, что биологические механизмы образования спаек схожи в различных областях хирургического вмешательства, препарат имеет потенциал к применению практически в любых анатомических локациях, считают авторы работы. Гидрогели различных составов находят применения в разных областях экспериментальной медицины: к примеру, их использовали для лечения инфаркта миокарда, закрытия язвы желудка, заживления ран при диабете, борьбы с раневыми инфекциями, повышения эффективности вакцин и соединения капилляров.