Szwajcarscy chemicy odkryli, że mocznik łatwo tworzy się z amoniaku i dwutlenku węgla, gdy reakcja jest prowadzona w mikrokroplach wody. Wykorzystali spektroskopię Ramana do wykrycia powstawania mocznika w pojedynczych mikrokroplach, a następnie powtórzyli eksperyment w aerozolu. Wyniki badania zostały opublikowane w czasopiśmie „Science”.
Cząsteczka mocznika składa się z dwóch grup aminowych przyłączonych do grupy karbonylowej i jest zasadniczo podwójnym amidem kwasu węglowego. W związku z tym można go wytwarzać z gazowego amoniaku NH3 i dwutlenku węgla CO2. Problem polega na tym, że reakcja ta zachodzi tylko w trudnych warunkach. Na przykład przemysłowa synteza mocznika odbywa się w temperaturze około 200 stopni Celsjusza i ciśnieniu około 15 atmosfer. W normalnych warunkach amoniak i dwutlenek węgla po prostu nie reagują. Jednak przepuszczanie mieszaniny tych gazów przez wodę prowadzi do powstania karbaminianu amonu, a nie mocznika.
Okazuje się jednak, że mocznik rzeczywiście może powstawać z dwutlenku węgla i wody pod ciśnieniem atmosferycznym i w temperaturze pokojowej. Zademonstrowała to Ruth Signorell i jej współpracownicy z ETH w Zurychu. Naukowcy przeprowadzili tę reakcję nie w zwykłej wodzie, lecz w kroplach wody o promieniu kilku mikrometrów.
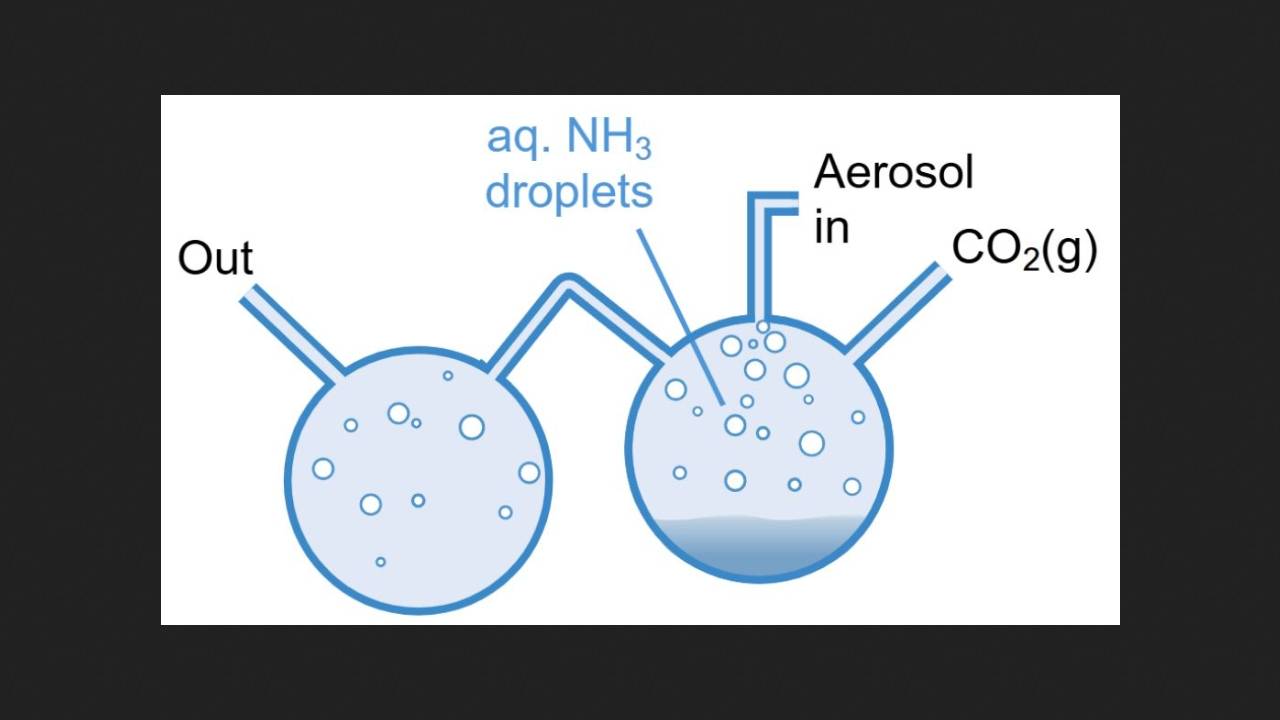
Chemicy przeprowadzili eksperyment, rozpylając wodny roztwór amoniaku i chwytając powstałe mikrokrople za pomocą pęsety optycznej. Następnie wprowadzili jedną atmosferę wilgotnego dwutlenku węgla do komory zawierającej kroplę, jednocześnie rejestrując jej widmo Ramana. Kilka minut po rozpoczęciu reakcji w widmie pojawiło się pasmo odpowiadające drganiom wiązania azot-węgiel w moczniku. Stężenie mocznika w kropli po 30 minutach reakcji wynosiło średnio około 40 milimoli na litr. Temperatura podczas eksperymentu wynosiła 20 stopni Celsjusza.
Następnie chemicy przeprowadzili tę samą reakcję, ale nie w pojedynczej kropli wody, lecz w aerozolu. W ten sposób również powstał mocznik, który naukowcy wykryli za pomocą spektrometrii mas i spektroskopii NMR z wykorzystaniem węgla. Jednak w tym przypadku ilość wytworzonego mocznika była znacznie mniejsza, ponieważ czas życia mikrokropli, a tym samym czas reakcji, wynosił około trzech minut.
Autorzy badania powtórzyli następnie eksperyment w zwykłej wodzie, na wszelki wypadek. W tym przypadku, zgodnie z oczekiwaniami, nie wytworzył się mocznik. Rola mikrokropli wynika prawdopodobnie z różnicy stężeń substancji wewnątrz kropli i na jej powierzchni. Każda kropla reprezentuje mały reaktor przepływowy, w którym panują różne warunki w różnych obszarach, w tym zróżnicowane pH. Chemicy uważają, że ten gradient stężeń umożliwia powstawanie mocznika. Zauważają jednak również, że mechanizmy reakcji w mikrokroplach są bardzo trudne do określenia i często stają się przedmiotem debaty w środowisku naukowym.
Chemicy wykazali zatem, że mocznik może powstawać z amoniaku i dwutlenku węgla w normalnych warunkach. Naukowcy sugerują, że właśnie w ten sposób mógł powstać mocznik w warunkach prebiotycznych.
Wcześniej informowaliśmy o tym, jak amoniak przedostaje się do mikrokropelek wody z powietrza wydychanego przez eksperymentatorów.