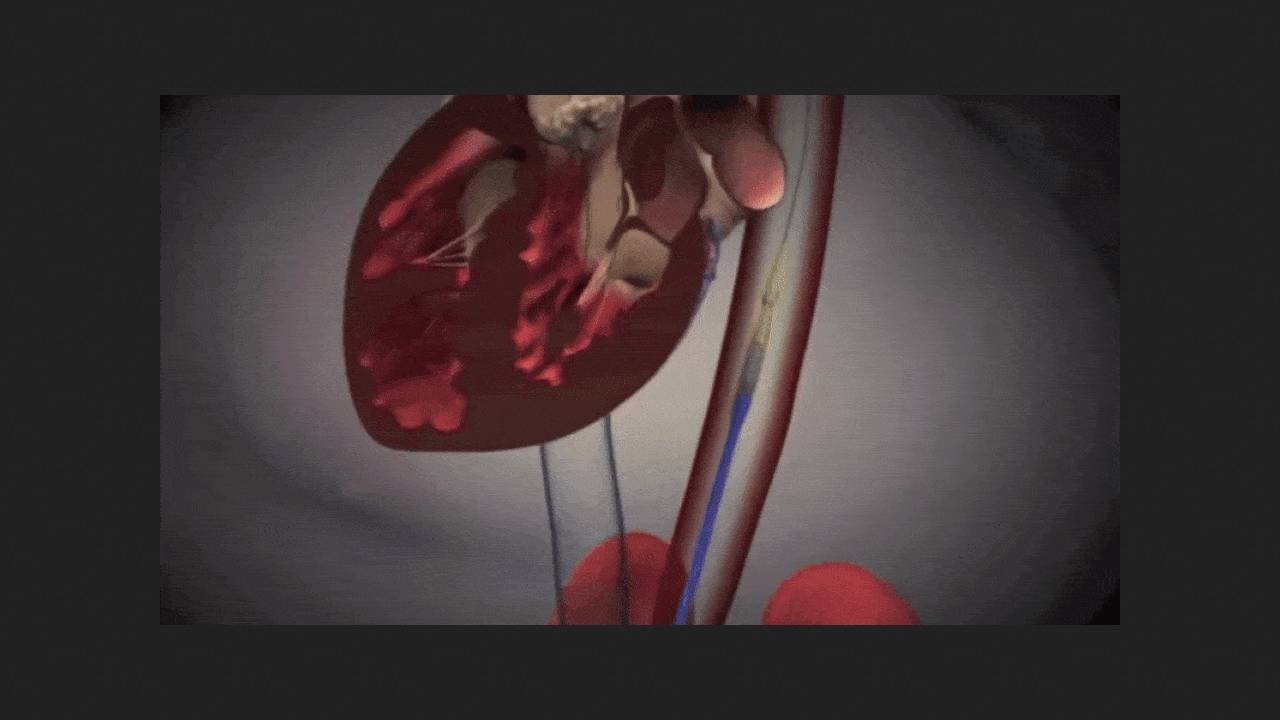
Amerykańska Agencja ds. Żywności i Leków (FDA) wydała pierwszą zgodę na przezcewnikową wymianę zastawki aortalnej (TAVR) w przypadku bezobjawowej ciężkiej stenozy aortalnej. System SAPIEN 3 firmy Edwards Lifesciences został zarejestrowany. Jak podkreślono w komunikacie prasowym firmy, bez leczenia co dziesiąty pacjent z objawami ciężkiej stenozy aortalnej umiera w ciągu pięciu tygodni od ich wystąpienia. Objawy mogą pojawić się niespodziewanie i postępować szybko i nieprzewidywalnie. Jednak do tej pory TAVR była wskazana wyłącznie u pacjentów z klinicznie jawną chorobą.
Decyzja została podjęta w oparciu o wyniki wieloośrodkowego, randomizowanego, kontrolowanego badania klinicznego EARLY TAVR, w którym wzięło udział 901 pacjentów z bezobjawową, ciężką stenozą aortalną. Spośród nich 455 poddano TAVR, a pozostałych 446 poddano dynamicznej obserwacji zgodnie z obowiązującymi wytycznymi. W okresie obserwacji, którego mediana wynosiła 3,8 roku, zgon, udar mózgu lub nieplanowana hospitalizacja z przyczyn sercowo-naczyniowych wystąpiły u 26,8% uczestników w grupie badanej w porównaniu z 45,3% w grupie kontrolnej (p < 0,001).