Amerykańscy naukowcy po raz pierwszy w historii przeszczepili pacjentowi jego własne niedojrzałe komórki macierzyste linii germinalnej, pobrane w dzieciństwie przed chemioterapią, która spowodowała bezpłodność, do jego jądra. Nie wiadomo, czy od tego czasu zaczął produkować plemniki. Opis techniki jest dostępny na stronie medRXiv.org, a historię pacjenta przedstawiła agencja prasowa AP.
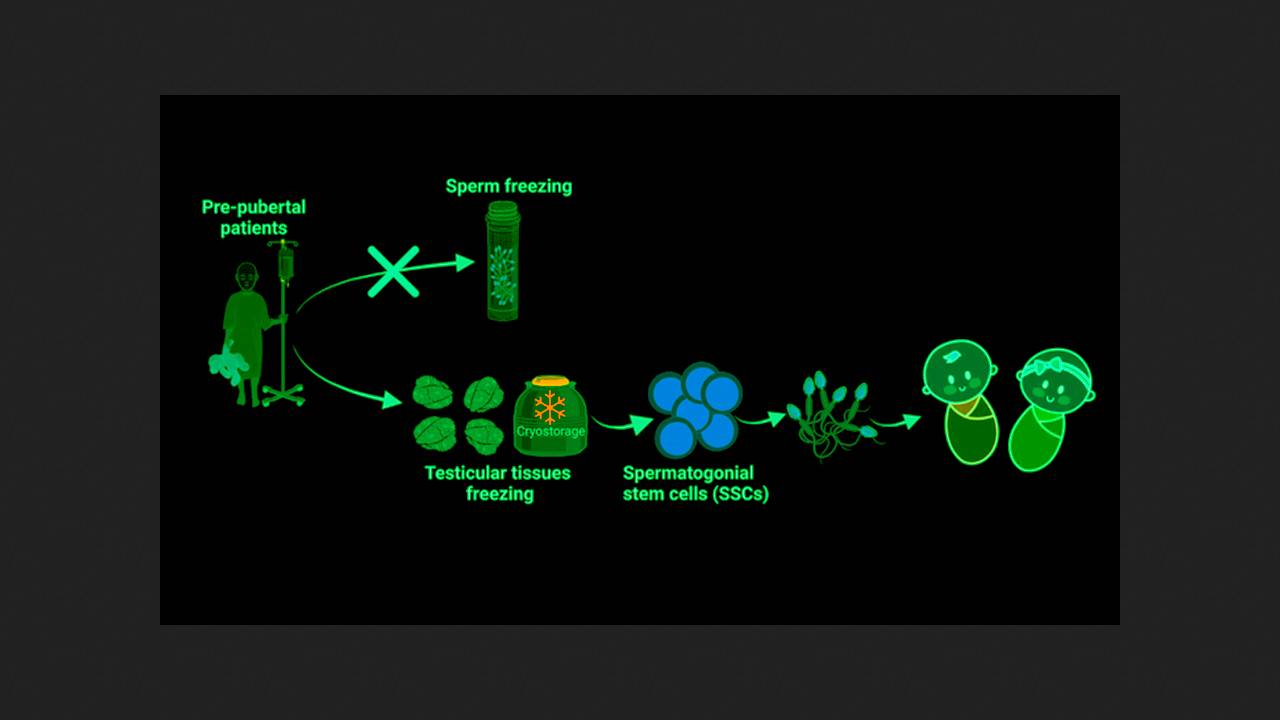
Dzięki współczesnej medycynie nawet 85% dzieci chorych na raka przeżywa dorosłość bez nawrotu. Jednak około co trzecie z nich pozostaje bezpłodne w wyniku chemioterapii, ponieważ aktywnie dzielące się komórki macierzyste linii germinalnej, z których powstają gamety (plemniki i komórki jajowe), są na nią wrażliwe. Aby umożliwić pacjentom onkologicznym posiadanie dzieci w przyszłości, obecnie oferowana jest kriokonserwacja dojrzałych plemników lub komórek jajowych, które nie są jednak wytwarzane przed okresem dojrzewania.
Laboratorium Kyle'a Orwiga na Uniwersytecie w Pittsburghu od wielu lat rozwija kriokonserwację i późniejszą replantację komórek macierzystych linii germinalnej (gametogonia). Po uzyskaniu pozytywnych wyników w eksperymentach na małpach, naukowcy rozpoczęli konserwację komórek macierzystych pobranych metodą biopsji igłowej od dzieci w wieku przedpokwitaniowym chorych na raka przed chemioterapią. Od 2011 roku laboratorium przechowuje oczyszczone hodowle komórkowe pochodzące od około 1000 chłopców do badań klinicznych.
Jednym z nich był Jaiwen Hsu, u którego w wieku 11 lat zdiagnozowano raka kości i który rozpoczął chemioterapię. Jego rodzice skontaktowali się z University of Pittsburgh Medical Center i zapisali go do programu krioprezerwacji komórek macierzystych. Ponad 10 lat później został pierwszym pacjentem z zachowanymi komórkami, który poprosił o przeszczep – analiza nasienia wykazała przewidywalną azoospermię (brak żywych plemników w ejakulacie). Nie planował wówczas zakładania rodziny, ale chciał sprawdzić, czy eksperyment się powiedzie.
W 2023 roku, w ramach odrębnego badania klinicznego, Oruig i jego współpracownicy przeprowadzili autologiczny przeszczep zawiesiny komórek jąder pacjenta zawierającej spermatogonie. W tym celu naukowcy wykorzystali technologię opracowaną i przetestowaną na zwierzętach. Pod kontrolą USG wprowadzili igłę przez podstawę moszny do sieci jądra (sieci Hallera) – która łączy się ze wszystkimi kanalikami nasiennymi, w których zachodzi produkcja plemników – i za pomocą tej igły precyzyjnie dostarczyli komórki macierzyste.
Zabieg przebiegł bez powikłań, a kolejne badanie USG wykazało prawidłową strukturę tkanki jąder. Poziom testosteronu, hormonu folikulotropowego i hormonu luteinizującego u pacjenta był prawidłowy, ale inhibina B (marker spermatogenezy) była niska. Badanie nasienia przeprowadzone rok po przeszczepie nadal wykazywało azoospermię. Oruig uważa, że jest za wcześnie, aby wyciągać wnioski – w eksperymentach na małpach, jedynie niewielka ilość plemników została pobrana drogą aspiracji, ale zostały one z powodzeniem wykorzystane do poczęcia poprzez zapłodnienie in vitro. Xu, który ma obecnie 26 lat, zauważył, że niezależnie od wyników, cieszy się z udziału w rozwoju technologii i jest wdzięczny swoim rodzicom za włączenie go do tego programu.
Równolegle z konserwacją komórek macierzystych linii germinalnej trwają eksperymenty mające na celu krioprezerwację nienaruszonych fragmentów tkanki jąder. W styczniu 2025 roku Ellen Goossens i współpracownicy z Wolnego Uniwersytetu Brukselskiego po raz pierwszy wszczepili pacjentowi taki fragment tkanki. Został on pobrany przed chemioterapią w wieku 10 lat i przechowywany przez 16 lat. Jest również za wcześnie, aby ocenić wyniki tego eksperymentu.