Amerykańscy naukowcy poinformowali o odkryciu nowej populacji neuronów, które są celami działania hormonu tkanki tłuszczowej – leptyny. Neurony te znajdują się w jądrze łukowatym podwzgórza i ekspresją bazonukleiny 2. Pobudzone leptyną, neurony te bezpośrednio hamują neurony AgRP, tym samym tłumiąc apetyt u myszy. Badanie zostało opublikowane w czasopiśmie „Nature”.
Leptyna, produkowana przez tkankę tłuszczową, utrzymuje homeostatyczną kontrolę masy tkanki tłuszczowej poprzez regulację spożycia pokarmu i bilansu energetycznego. Dzieje się to poprzez hamowanie neuronów AgRP i neuronów ekspresjonujących neuropeptyd Y, a także aktywację neuronów ekspresjonujących podwzgórzową proopiomelanokortynę (neurony POMC). Wszystkie te neurony znajdują się w jądrze łukowatym podwzgórza.
Ogólnie rzecz biorąc, dwie populacje neuronów – neurony AgRP i neurony POMC – antagonistycznie regulują pobieranie pokarmu za pośrednictwem leptyny. Jednak efekty funkcjonalne i dynamika procesów zachodzących w tych neuronach różnią się pod kilkoma istotnymi względami, a szereg dowodów sugeruje istnienie innych, wrażliwych na leptynę populacji neuronów, które mogą mieć kluczowe znaczenie dla zależnej od leptyny kontroli pobierania pokarmu i masy ciała.
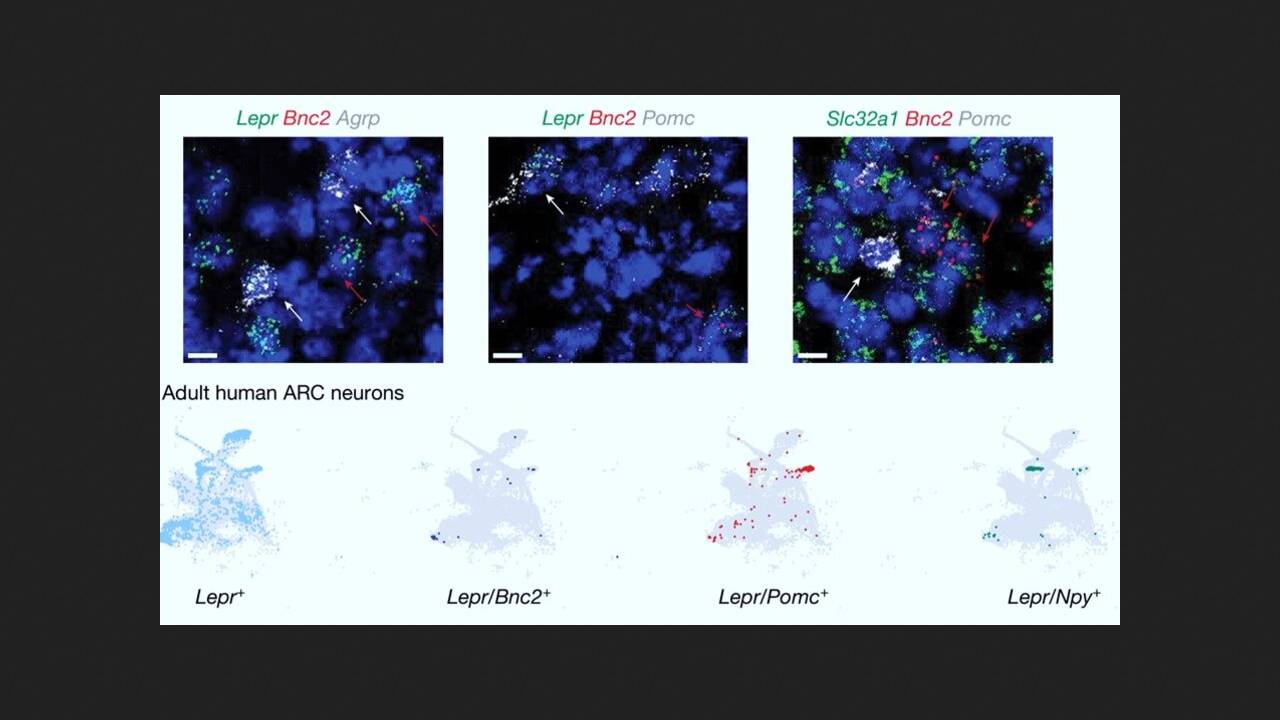
Naukowcy pod kierownictwem Jeffreya Friedmana z Uniwersytetu Rockefellera systematycznie profilowali transkryptomy neuronów w jądrze łukowatym podwzgórza u myszy, stosując sekwencjonowanie RNA pojedynczego jądra. Odkryto, że jeden klaster zawierał wcześniej nieopisane neurony z ekspresją receptora leptyny. Neurony te zidentyfikowano jako ekspresjonujące bazonuklinę 2 (neurony BNC2), białko o strukturze palca cynkowego, zaangażowane w regulację splicingu, przetwarzania i transkrypcji mRNA, i odgrywające kluczową rolę we wczesnym rozwoju embrionalnym.
Aby dokładniej zbadać dynamikę i funkcję neuronów BNC2, naukowcy wyhodowali linię myszy z wyłączonym genem BNC2. Eksperymenty wykazały, że neurony BNC2 reagują na bodźce sensoryczne związane z jedzeniem w zależności od doświadczenia, a spożycie pokarmu dodatkowo aktywuje te neurony. W eksperymencie myszom, które głodowały przez noc, podawano pokarm przez dwie lub dziesięć minut. Po odstawieniu pokarmu aktywność neuronów BNC2 gwałtownie spadła, ale pozostała wysoka przy stałym dostępie do pożywienia.
Dalsze badania molekularne ujawniły, że niektóre sygnały sensoryczne, które hamują neurony AgRP i zmniejszają apetyt po posiłku, są przekazywane przez neurony BNC2. Następnie, kilka eksperymentów wykazało, że leptyna zwiększa aktywność neuronów BNC2. Neurony te z kolei bezpośrednio hamują aktywność neuronów AgRP, co prowadzi do tłumienia apetytu.
Usunięcie receptorów leptyny w neuronach BNC2 powodowało nadmierny apetyt i prowadziło do otyłości u myszy. Podobne zmiany zaobserwowano po usunięciu genów receptorów leptyny w neuronach AgRP. Co istotne, naukowcy zaobserwowali również poprawę tolerancji glukozy i wrażliwości na insulinę u myszy po aktywacji neuronów BNC2.
Naukowcy doszli zatem do wniosku, że populacja neuronów BNC2 w jądrze łukowatym podwzgórza bezpośrednio i szybko reguluje odżywianie i równowagę energetyczną. Wyniki te dodają nowy, ważny element do obwodów neuronalnych odpowiedzialnych za apetyt i jego zaburzenia oraz przyczyniają się do zrozumienia mechanizmów, za pomocą których leptyna reguluje ten układ. Potencjalnie, farmakologiczna aktywacja tych neuronów może mieć wartość terapeutyczną w odchudzaniu.
Wcześniej informowaliśmy, że smak i zapach jedzenia powodują fragmentację mitochondriów w wątrobie poprzez aktywację neuronów POMC.