Hiszpańscy naukowcy przeprowadzili wieloomową analizę pojedynczych komórek w preparacie infuzyjnym terapeutycznych limfocytów T z chimerycznymi receptorami antygenowymi i odkryli, że skład i właściwości komórek w nim zawartych, a także ich dynamika po podaniu, znacząco wpływają na skuteczność leczenia. Raport z badań został opublikowany w czasopiśmie „Cell Reports Medicine”.
Limfocyty T z chimerycznymi receptorami antygenowymi (limfocyty CAR-T) umożliwiają osiągnięcie radykalnych sukcesów w leczeniu pacjentów onkologicznych, aż do całkowitego wyleczenia (więcej o tej technologii można przeczytać w materiale „Chimera przeciwko rakowi”). Obecnie leki stosowane w leczeniu nowotworów onkohematologicznych komórek B oraz jednej z odmian mięsaków maziówkowych znalazły zastosowanie kliniczne. Jednocześnie skutecznie pomagają one około połowie pacjentów, u których inne rodzaje terapii nie przyniosły rezultatu, a u drugiej połowy odpowiedź jest niewystarczająca lub nie występuje wcale. Prawdopodobieństwo sukcesu zależy od wielu czynników, których badania są obecnie kontynuowane.
Pablo Menéndez z Instytutu Badań nad Białaczką im. Josepa Carrerasa wraz ze współpracownikami przeprowadził kompleksową analizę kinetyki klonalnej i heterogenności transkryptomicznej produktów infuzyjnych z limfocytów T CD19-CAR (varnimcabtagen autoleucel, varni-cel) wytworzonych ex vivo u pięciu pacjentów z oporną na leczenie lub nawracającą ostrą białaczką limfoblastyczną komórek B. W tym celu przeprowadzili sekwencjonowanie receptora limfocytów T αβ i RNA w pojedynczych komórkach izolowanych metodą cytometrii przepływowej, bazując na zasadzie ekspresji CAR. Analiza dynamiki komórek obejmowała zarówno transdukowane (CAR-dodatnie), jak i nietransdukowane (CAR-ujemne) limfocyty T produktu.
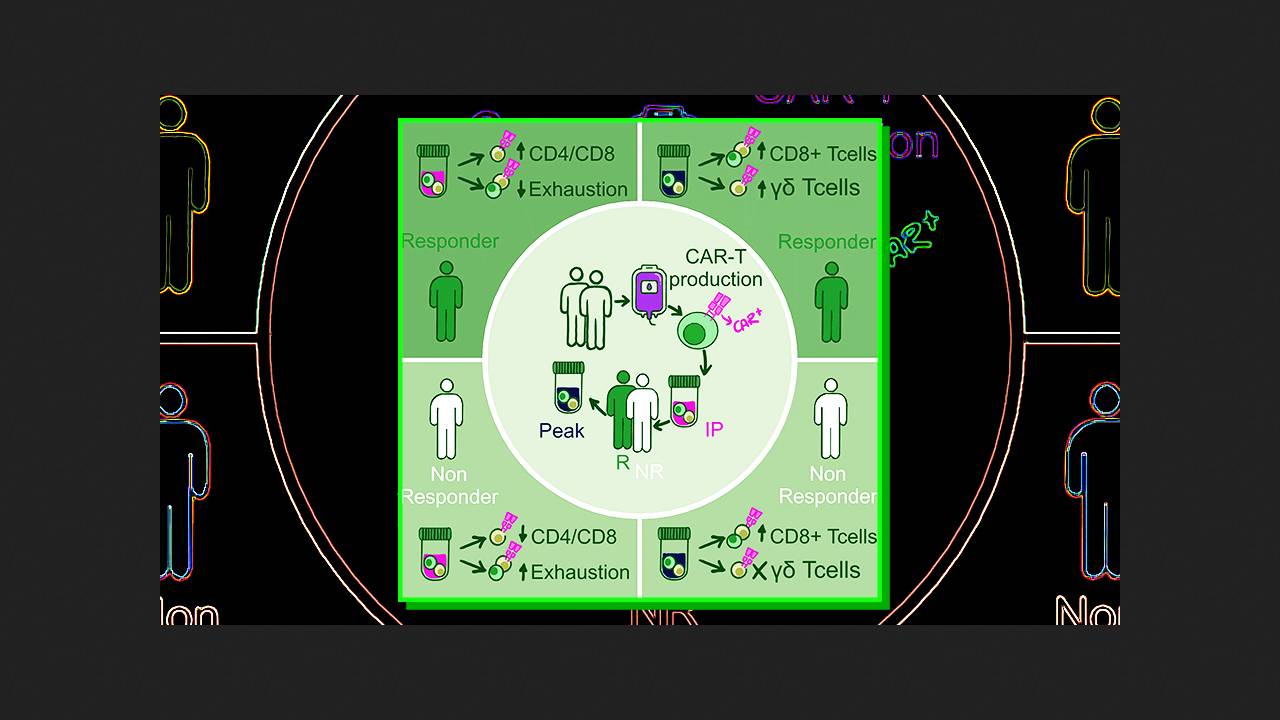
Poziom transdukcji CAR w produktach infuzyjnych wynosił od 23 do 38 procent. Poziomy proliferacji limfocytów CAR-T w organizmie pacjentów były różne, osiągając szczyt między pierwszym a czwartym tygodniem po infuzji. U dwóch pacjentów zaobserwowano wczesny nawrót w drugim i trzecim miesiącu, u jednego – późny nawrót w szóstym, u dwóch pacjentów uzyskano stabilną pełną odpowiedź na terapię. Łącznie przeanalizowano 37,1 tysiąca pojedynczych limfocytów T wysokiej jakości we wszystkich próbkach w różnych stadiach. Wyraźnie rozróżniono w nich skupiska naiwnych komórek CD4+; komórki efektorowe, pamięci i cytotoksyczne CD8+, a także cytotoksyczne komórki T γδ.
Porównanie podtypów komórek CAR-dodatnich i CAR-ujemnych w produkcie infuzyjnym wykazało, że te pierwsze proliferują znacznie aktywniej, a wśród nieproliferującej frakcji tych drugich obserwuje się istotnie większy odsetek komórek efektorowych CD8+. Jak się okazało, u pacjentów z całkowitą odpowiedzią na terapię, komórek CAR-dodatnich CD4+ w produkcie infuzyjnym było co najmniej trzykrotnie więcej niż CD8+. Wpływ tego stosunku na skuteczność leczenia potwierdzono (p = 0,03) w oddzielnej kohorcie 47 pacjentów z ostrą białaczką limfoblastyczną B-komórkową. Jednocześnie ekspresja markerów deplecji limfocytów T, poprzedzająca transdukcję, ujemnie korelowała z sukcesem terapii.
W szczytowym okresie reprodukcji w organizmie pacjenta udział proliferujących limfocytów T CAR-dodatnich i CAR-ujemnych zmniejszył się, a ich miejsce zajęły komórki CD8+, podczas gdy wśród nieproliferujących limfocytów CAR-dodatnich przeważały one nad CD4+. Jednocześnie populacja limfocytów T γδ, zarówno dodatnich, jak i ujemnych, w szczytowym okresie znacząco wzrosła, a jej wzrost był bezpośrednio skorelowany ze skutecznością terapii. Znaczenie kliniczne tych komórek potwierdzono w retrospektywnych kohortach 18 pacjentów z ostrą białaczką limfoblastyczną z komórek B, którzy otrzymywali Varni-Cel, oraz 58 pacjentów z rozlanym chłoniakiem z dużych komórek B, którzy otrzymywali Axi-Cel lub Thysa-Cel.
Uzyskane wyniki wskazują na złożony charakter odpowiedzi limfocytów T podczas terapii CD19-CAR-T, która nie ogranicza się do limfocytów T αβ dodatnich pod względem ekspresji receptorów CAR. W szczególności, stosunek komórek CD4+/CD8+ w preparacie do infuzji, poprzedzający deplecję komórek i proliferację limfocytów T γδ po infuzji, ma ogromne znaczenie. Wpływ na te czynniki może zwiększyć skuteczność leczenia w przyszłości, podsumowują autorzy artykułu.
Wcześniej amerykańskim badaczom udało się wielokrotnie zwiększyć skuteczność terapii CAR-T w badaniach przedklinicznych na myszach, wykorzystując w tym celu eksperymentalnie zmodyfikowaną ludzką interleukinę-7, która stymuluje wzrost limfocytów.