Hiszpańscy naukowcy przeprowadzili analizę multiomiczną pojedynczych komórek w preparacie infuzyjnym zawierającym terapeutyczne chimeryczne komórki T receptorowe antygenów i odkryli, że skład i właściwości komórek, a także ich dynamika po podaniu, znacząco wpływają na skuteczność leczenia. Ich raport został opublikowany w czasopiśmie „Cell Reports Medicine”.
Chimeryczne komórki T z receptorem antygenowym (komórki CAR-T) umożliwiają radykalny postęp w terapii nowotworowej, w tym całkowite wyleczenie (więcej informacji na temat tej technologii można znaleźć w artykule „Chimera kontra rak”). Obecnie do użytku klinicznego weszły leki stosowane w leczeniu nowotworów hematologicznych z komórek B oraz pewnego rodzaju mięsaków maziówkowych. Leki te są skuteczne u około połowy pacjentów, u których inne terapie okazały się nieskuteczne, podczas gdy u pozostałej połowy odpowiedź jest niewystarczająca lub nie występuje wcale. Prawdopodobieństwo sukcesu zależy od wielu czynników, które są obecnie przedmiotem badań.
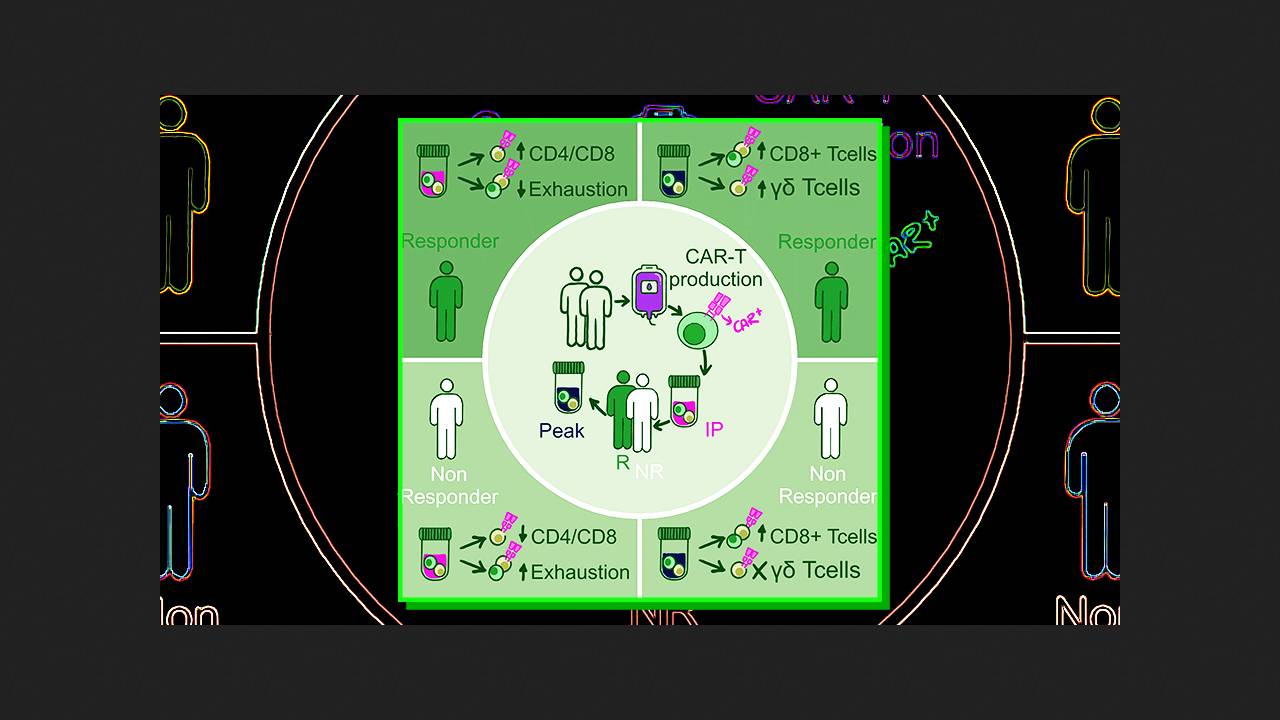
Pablo Menéndez z Instytutu Badań nad Białaczką im. Josepa Carrerasa wraz ze współpracownikami przeprowadził zintegrowaną analizę kinetyki klonalnej i heterogenności transkryptomicznej produktów infuzyjnych z limfocytów T CD19-CAR (varnimcabtagene autoleucel, varni-cel) wytworzonych ex vivo dla pięciu pacjentów z oporną lub nawrotową ostrą białaczką limfoblastyczną komórek B. Przeprowadzili sekwencjonowanie receptorów limfocytów T αβ i RNA w pojedynczych komórkach wyizolowanych metodą cytometrii przepływowej na podstawie ekspresji CAR. Analiza dynamiki komórkowej obejmowała zarówno limfocyty T transdukowane (CAR-dodatnie), jak i nietransdukowane (CAR-ujemne) w produkcie.
Współczynnik transdukcji CAR w produktach infuzyjnych wahał się od 23 do 38 procent. Tempo proliferacji limfocytów T CAR różniło się u poszczególnych pacjentów, osiągając szczyt między pierwszym a czwartym tygodniem po infuzji. U dwóch pacjentów wystąpiły wczesne nawroty w drugim i trzecim miesiącu, u jednego późny nawrót w szóstym miesiącu, a u dwóch uzyskano trwałą całkowitą odpowiedź na terapię. Przeanalizowano łącznie 37 100 pojedynczych limfocytów T wysokiej jakości we wszystkich próbkach na różnych etapach. Wyraźnie widoczne były skupiska naiwnych komórek CD4+, komórek efektorowych, pamięci i cytotoksycznych komórek CD8+ oraz cytotoksycznych komórek γδ.
Porównanie podtypów komórek CAR-dodatnich i CAR-ujemnych w produkcie infuzyjnym wykazało, że te pierwsze proliferują istotnie aktywniej, podczas gdy frakcja nieproliferująca tych drugich zawiera istotnie wyższy odsetek komórek efektorowych CD8+. U pacjentów z całkowitą odpowiedzią na terapię stwierdzono co najmniej trzykrotnie więcej komórek CD4+ dodatnich pod względem CAR w produkcie infuzyjnym niż komórek CD8+. Wpływ tego stosunku na skuteczność został potwierdzony (p = 0,03) w oddzielnej kohorcie 47 pacjentów z ostrą białaczką limfoblastyczną B-komórkową. Ponadto, ekspresja markerów deplecji limfocytów T poprzedzająca transdukcję ujemnie korelowała z sukcesem leczenia.
W szczytowym momencie proliferacji odsetek proliferujących limfocytów T CAR-dodatnich i CAR-ujemnych w organizmach pacjentów zmniejszył się, a ich miejsce zajęły komórki CD8+, które przeważały nad komórkami CD4+ wśród nieproliferujących komórek CAR-dodatnich. Jednocześnie populacja zarówno dodatnich, jak i ujemnych limfocytów T γδ znacząco wzrosła w szczytowym momencie, a jej wzrost był bezpośrednio skorelowany ze skutecznością terapii. Znaczenie kliniczne tych komórek zostało potwierdzone w retrospektywnych kohortach 18 pacjentów z ostrą białaczką limfoblastyczną z komórek B leczonych Varnicelem oraz 58 pacjentów z rozlanym chłoniakiem z dużych komórek B leczonych Axicelem lub Tisacelem.
Uzyskane wyniki wskazują na złożoną naturę odpowiedzi limfocytów T w terapii CD19-CAR-T, która nie ogranicza się do limfocytów T αβ dodatnich pod względem receptora CAR. W szczególności, stosunek komórek CD4+/CD8+ w preparacie do infuzji, wcześniejsze zmniejszenie liczby komórek oraz ekspansja limfocytów T γδ po infuzji mają ogromne znaczenie. Autorzy podsumowują, że wpływ na te czynniki może potencjalnie poprawić skuteczność leczenia.
Wcześniej amerykańskim badaczom udało się znacząco zwiększyć skuteczność terapii CAR-T w badaniach przedklinicznych na myszach, wykorzystując eksperymentalną zmodyfikowaną ludzką interleukinę-7, która stymuluje wzrost limfocytów.