Niemieccy chemicy odkryli, jak krzyżowo sprzęgać aniliny z kwasami boronowymi. Aniliny przekształcono w sole diazoniowe, które następnie dodano utleniająco do katalizatora palladowego. Badanie zostało opublikowane w czasopiśmie „Angewandte Chemie International Edition”.
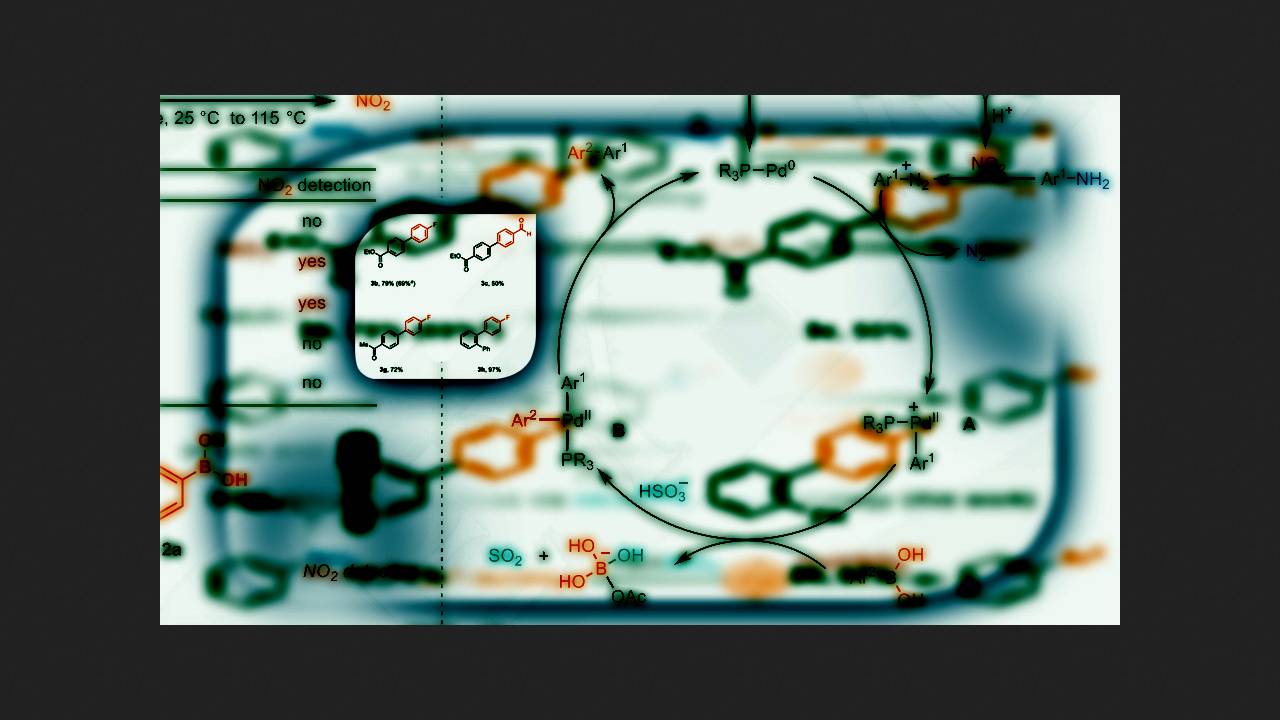
W klasycznej reakcji sprzęgania Suzuki kwas boronowy i halogenek arylu reagują, tworząc wiązanie węgiel-węgiel w obecności katalizatora palladowego. W tej reakcji zamiast halogenków arylu można zastosować aniliny, ale wymaga to ich wcześniejszej konwersji do niestabilnych, a czasem wybuchowych soli diazoniowych.
Aby rozwiązać ten problem, chemicy pod kierownictwem Tobiasa Rittera z Instytutu Badań Węgla im. Maxa Plancka postanowili zastosować niedawno opracowaną metodę generowania soli diazoniowych z anilin za pomocą azotanów. Wcześniej stosowali tę metodę do wytwarzania aromatycznych pochodnych halogenowych z anilin i okazała się ona bezpieczniejsza niż klasyczne diazowanie, ponieważ sole diazoniowe nie kumulowały się w mieszaninie reakcyjnej.
Z tego samego powodu chemicy postanowili zastosować tę metodę do reakcji Suzuki z anilinami. Najpierw zmieszali kwas 4-fluoroboronowy i 4-metyloanilinę w obecności różnych katalizatorów palladowych, azotanu tert-butyloamoniowego i innych dodatków. Stwierdzili, że reakcja przebiegała z wydajnością 69%, gdy jako reduktor zastosowano wodorosiarczyn sodu (NaHSO3). W swojej poprzedniej pracy naukowcy używali tiosiarczanu sodu (Na2S2O3), ale podejrzewali, że wiązał się on zbyt silnie z katalizatorem palladowym, przez co reakcja Suzuki praktycznie nie zachodziła w jego obecności.
Chemicy przetestowali wybrane warunki reakcji na różnych anilinach i kwasach boronowych. Okazało się, że warunki te pozwalają na zastosowanie nie tylko anilin, ale także heterocykli aminowych. Co więcej, dzięki szybkiej addycji utleniającej związków diazowych, reakcja była selektywna nawet w obecności aromatycznych pochodnych bromu. Główną wadą tej reakcji, jak zauważają autorzy, jest niska wydajność produktów przy użyciu kwasów boronowych z podstawnikami donorowymi w pierścieniu aromatycznym.
W ten sposób chemicy opracowali ogólną metodę syntezy pochodnych biarylowych z anilin i kwasów boronowych. Zastosowali bezpieczniejszą metodę azotanową do generowania związków diazowych, a wydajność większości produktów wynosiła 40% lub więcej.
Niedawno informowaliśmy o tym, jak naukowcy wykorzystali katalizator na bazie żelaza, a nie palladu, do przeprowadzenia reakcji Suzuki.