Amerykańscy naukowcy opracowali farmakologicznie aktywny hydrożel do zapobiegania powstawaniu zrostów pooperacyjnych. W eksperymentach na świniach skutecznie zapobiegał on powstawaniu zrostów po operacjach jelit, nie zakłócając gojenia ani nie powodując toksyczności ogólnoustrojowej. Raport z badania został opublikowany w czasopiśmie „Science Translational Medicine”.
Zrosty powstają po 50–90% operacji jamy brzusznej, stanowią główną przyczynę niedrożności jelit, mogą powodować przewlekły ból i niepłodność oraz utrudniać kolejne operacje. Oprócz dyskomfortu i pogorszenia jakości życia, stanowią dodatkowe obciążenie dla systemu opieki zdrowotnej i generują znaczne koszty finansowe. Obecnie nie ma sprawdzonych metod zapobiegania zrostom ani ich leczenia, głównie z powodu braku zrozumienia mechanizmów ich powstawania i patogenezy zrostów.
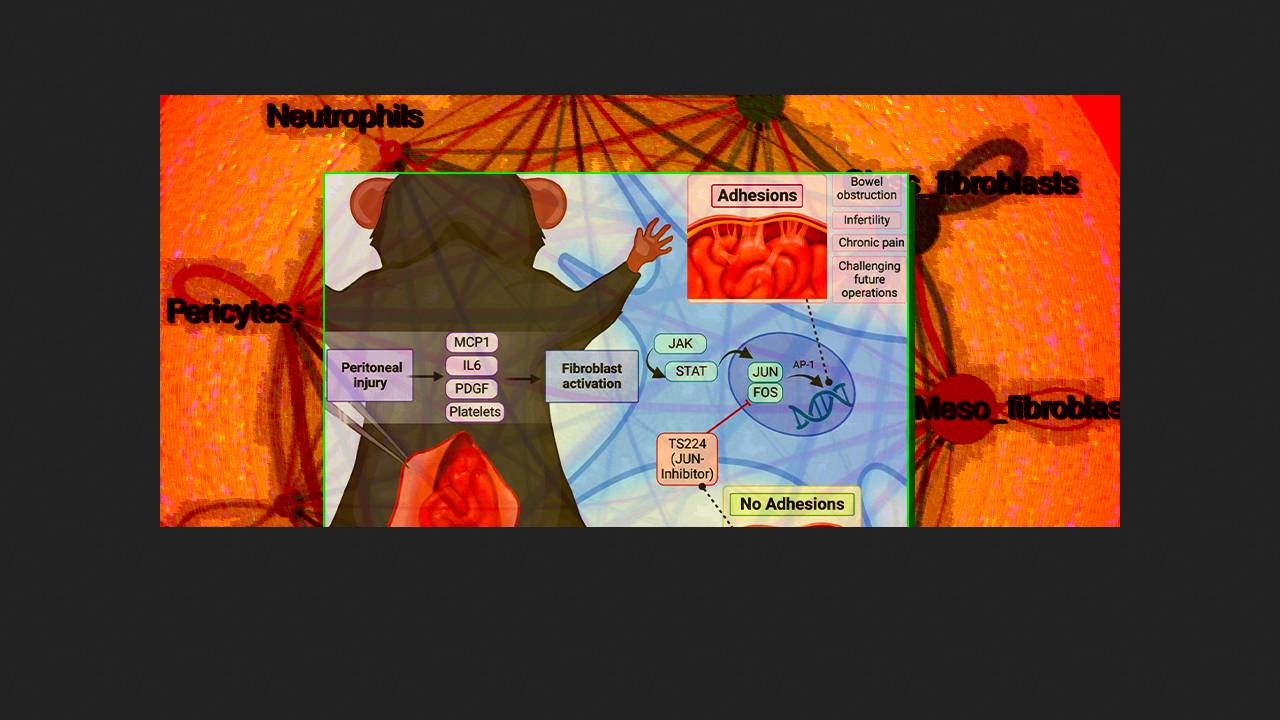
W 2020 roku zespół naukowców z Uniwersytetu Stanforda pod kierownictwem Michaela Longakera przedstawił wyniki fundamentalnej analizy tkanek zrostowych u myszy i ludzi. Zgodnie z ich danymi, zrosty powstają głównie w otrzewnej trzewnej w wyniku poliklonalnej proliferacji fibroblastów tkankowych, które syntetyzują tkankę bliznowatą, zakotwiczającą struktury wewnątrzbrzuszne i unieruchamiającą jelito. Głównym regulatorem tego procesu (genezy zrostów) jest czynnik transkrypcyjny Jun, który wraz z białkiem Fos tworzy kompleks AP-1 i inicjuje proliferację oraz syntezę macierzy zewnątrzkomórkowej. Małocząsteczkowy inhibitor kompleksu AP-1, T-5224, zahamował pooperacyjną ekspresję Jun i ograniczył tworzenie się zrostów u myszy.
Aby przełożyć te odkrycia na praktykę kliniczną, w nowym badaniu Longaker i współpracownicy osadzili T-5224 w hydrożelu hydroksypropylometylocelulozowym z modyfikowanymi hydrofobowymi łańcuchami bocznymi i usieciowali je biokompatybilnymi micelami detergentu Tween. Właściwości barierowe tego materiału synergizują z działaniem farmakologicznym T-5224, a jego konsystencja umożliwia aplikację do otrzewnej w miejscu operacji za pomocą strzykawki lub sprayu. Eksperymenty potwierdziły, że hydrożel ma optymalne właściwości reologiczne i, przy stężeniach milimolarnych, zapewnia ciągłe uwalnianie substancji czynnej przez 14 dni – klinicznie krytyczny czas dla tworzenia się adhezji.
После успешных испытаний гидрогеля на мышах исследователи приступили к опытам на минипигах, устройство желудочно-кишечного тракта и развитие спаечной болезни у которых близко к человеческим. Для этого они разработали и проверили модель спайкообразования, включающую лапаротомию по средней линии, ревизию брюшной полости, резекцию тонкой кишки с ручным наложением анастомоза, скарификацию брюшины правой боковой стенки, промывание изотоническим солевым раствором и ушивание брюшной стенки. Замещение в этой модели солевого раствора на гидрогель с T-5224 приводило к значительно меньшему образованию спаек при ревизии через четыре недели как макроскопически, так и гистологически (в обоих случаях p < 0,0001), причем сформировавшиеся волокна матрикса в присутствии гидрогеля были менее зрелыми и плотными. Анализы показали, что T-5224 хорошо всасывался клетками местно, а его концентрация в крови была низкой и уменьшалась со временем. Признаков гематологической, печеночной и почечной токсичности, влияния на массу тела, а также гистологических изменений внутренних органов выявлено не было. На заживление кишечных анастомозов (в том числе при высокожировой диете) и их механические свойства, а также на регенерацию поврежденной кожи внутрибрюшинное введение гидрогеля значимо не влияло. Секвенирование отдельных клеток спаечной ткани показало, что использование активного препарата подавляло сигнальный путь Jun, причем эффекты этого были значительно более выраженными в мезотелиальных фибробластах, способствующих формированию фиброзных рубцов, чем в ремоделирующих фибробластах, предположительно отвечающих за регенерацию тканей после операции. Таким образом, гидрогель с T-5224 стойко препятствует образованию послеоперационных спаек брюшины без негативного влияния на состояние кишечного анастомоза и заживление брюшной стенки, а также без признаков системной токсичности. Учитывая, что биологические механизмы образования спаек схожи в различных областях хирургического вмешательства, препарат имеет потенциал к применению практически в любых анатомических локациях, считают авторы работы. Гидрогели различных составов находят применения в разных областях экспериментальной медицины: к примеру, их использовали для лечения инфаркта миокарда, закрытия язвы желудка, заживления ран при диабете, борьбы с раневыми инфекциями, повышения эффективности вакцин и соединения капилляров.