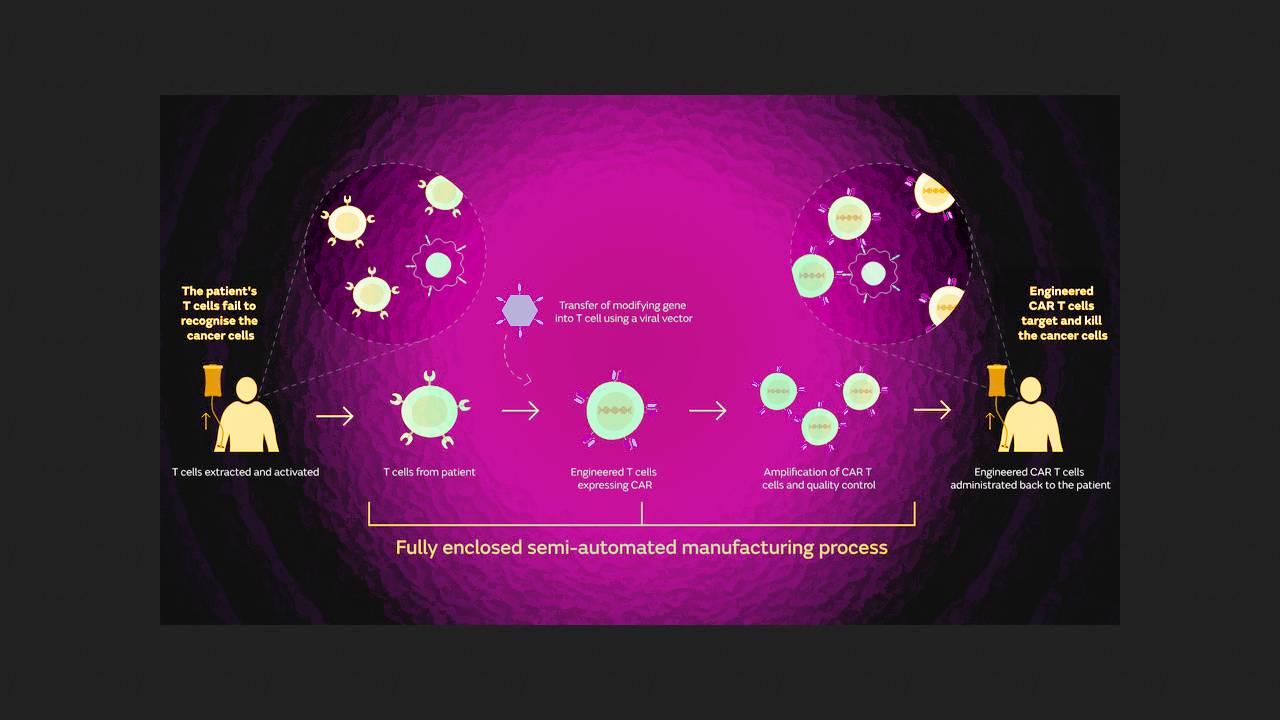
8 listopada 2024 roku Amerykańska Agencja ds. Żywności i Leków (FDA) zatwierdziła obecabtagen autoleucel do leczenia nawrotowej lub opornej ostrej białaczki limfoblastycznej (ALL) z prekursorami limfocytów B. Jest to autologiczny limfocyt T CAR 41BB-ζ anty-CD19 z białkiem scFv o pośrednim powinowactwie. Wyniki badania klinicznego FELIX, które doprowadziło do zatwierdzenia leku przez FDA, zostały oficjalnie opublikowane w czasopiśmie New England Journal of Medicine prawie 20 dni później. Badanie zostało przeprowadzone przez Claire Roddie z University College London i jej współpracowników z Wielkiej Brytanii, Hiszpanii i Stanów Zjednoczonych.
Spośród 94 uczestników wieloośrodkowego badania fazy 2A, 77% osiągnęło remisję w okresie obserwacji o medianie 20,3 miesiąca, przy czym u 55% uzyskano całkowitą remisję, a u 21% całkowitą remisję z niepełną regeneracją hematologiczną. Ciężkie (stopnia 3 lub wyższego) działania niepożądane związane z leczeniem obserwowano stosunkowo rzadko: zespół uwalniania cytokin (CRS) wystąpił u 2,4% uczestników, a zespół ICAN (ICAN) u 7,1% uczestników.