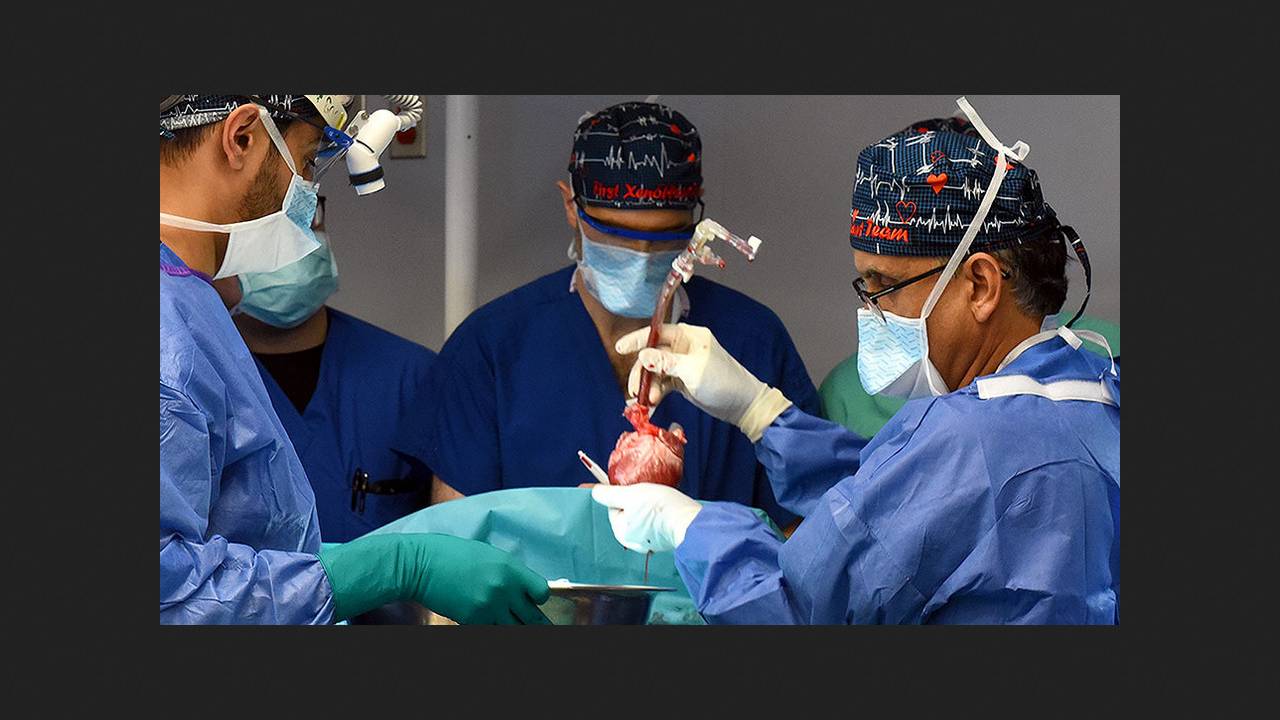
Amerykańscy i francuscy naukowcy przeprowadzili szczegółową analizę kliniczną i histopatologiczną choroby u drugiego pacjenta, który otrzymał genetycznie zmodyfikowane serce wieprzowe i żył z nim przez prawie sześć tygodni. Stwierdzono u niego uszkodzenie śródbłonka naczyń włosowatych serca, obrzęk tkanki łącznej i zwłóknienie. Wyniki analizy opublikowano w czasopiśmie „Nature Medicine”.
Prowadzone są eksperymenty z genetyczną modyfikacją świń w celu zwiększenia ich zgodności tkankowej z ludzkimi, aby zmniejszyć niedobór narządów do przeszczepów. Pierwszym biorcą genetycznie zmodyfikowanego serca świńskiego był 57-letni Amerykanin David Bennett, który w 2022 roku cierpiał na niewydolność serca z powodu ciężkiej arytmii. Operacja w University of Maryland Medical Center zakończyła się sukcesem, ale dwa miesiące później pacjent zmarł z powodu reakcji śródbłonka przeszczepionego narządu na podane immunoglobuliny i prawdopodobnie aktywacji świńskiego cytomegalowirusa. Retrospektywna analiza EKG wykazała również nieprawidłowości w przewodzeniu przedsionkowym i komorowym, z objawami wysokiego ryzyka arytmii, rozpoczynającymi się już w pierwszym dniu po operacji.
Drugim pacjentem, któremu w tym samym ośrodku przeszczepiono serce wieprzowe z 10 modyfikacjami genetycznymi, był 58-letni Lawrence Fossett. Jego niewydolność serca, z frakcją wyrzutową 15%, była spowodowana ciężką kardiomiopatią niedokrwienną, która postępowała pomimo pomostowania aortalno-wieńcowego. Z powodu ciężkiej miażdżycy w wielu tętnicach i niedawnego krwawienia z przewodu pokarmowego, nie kwalifikował się do konwencjonalnego przeszczepu i wyraził zgodę na procedurę eksperymentalną. Narząd genetycznie zmodyfikowany został dostarczony przez firmę Revivicor, której pracownicy brali udział w tym badaniu.
Как пишут Мухаммад Мохиуддин (Muhammad Mohiuddin) из Университета Мэриленда с соавторами, за день до операции и непосредственно перед ней пациенту проводили дефибрилляцию по поводу фибрилляции желудочков. За день до операции ему начали вводить экспериментальный препарат тегобрупарт — моноклональные антитела к CD40L для снижения риска отторжения. Подобранное по массе и габаритам свиное ГМ-сердце после соединения с системой кровообращения мужчины функционировало хорошо с частотой сокращений 40 ударов в минуту. Кардиостимулятором эту частоту довели до 80–90 ударов в минуту, фармакологической стимуляции не потребовалось. После операции прошел отек легких, однако повреждение почек потребовало постоянного диализа. На четвертый день произошло кровотечение в средостение из-за электрода кардиостимулятора, по поводу которого пациента прооперировали и перелили препараты крови. На седьмой день у него произошла остановка сердца и дыхания, через четыре минуты его успешно реанимировали без неврологических последствий и установили трахеостому.
Мониторинг сердца в первые несколько дней показывал фракцию выброса 55–65 процентов (норма) при кардиостимуляции с частотой 115–120 ударов в минуту. Глобальная продольная деформация (показатель сократимости миокарда) была стойко −19 и менее (норма менее −15). Катетеризация на 13 день определила сердечный выброс 3,82 литра в минуту, сердечный индекс 1,91 литра в минуту и центральное венозное давление 4 миллиметра ртутного столба (все ниже нормы). У пациента наблюдалось неконтролируемое расширение сосудов (вазоплегия), требующее постоянного введение вазопрессорных препаратов. Биопсия в тот же день выявила небольшие участки активации эндотелиальных клеток и большое количество антител и компонентов системы комплемента (IgG, IgM, C3d и C4d) в капиллярах без признаков повреждения эндотелия. Сывороточный уровень антител к свиным тканям был невысоким. Для профилактики реакции отторжения мужчине выполнили терапевтическую плазмофильтрацию и ввели анти-С5 моноклональные антитела экулизумаб. Признаков отторжения не наблюдалось. Из-за тяжелой неинфекционной воспалительной диареи на 15 день пациент похудел на 15 килограмм, и его перевели на полное парентеральное питание. Продолжительный скрининг на свиные вирусы давал отрицательные результаты.
На 29 день произошла острая декомпенсация кровообращения, потребовавшая интенсивной терапии. На следующий день врачи выполнили экстренную катетеризацию правых отделов сердца, показавшую рестриктивный тип сердечной недостаточности, и взяли повторную биопсию. Она снова выявила отложения IgG, IgM, C3d и C4d, а также диффузную активацию эндотелия с очагами апоптоза и вторичной ишемией кардиомиоцитов. Еще через день пациенту начали проводить экстракорпоральную мембранную оксигенацию (ЭКМО) и интенсивную терапию по профилактике отторжения и поддержанию кровообращения. Они не дали желаемых результатов, пациент, посоветовавшись с семьей, выбрал оказание паллиативной помощи и вскоре умер.
Autopsja ujawniła pogrubiony ksenograft o wadze 480 gramów (przed operacją ważył 273 gramy). Histologicznie zaobserwowano rozległe uszkodzenia i ubytki śródbłonka z wtórnymi obszarami niedokrwienia i martwicy mięśnia sercowego, a także niewyjaśnioną reakcję makrofagów w obszarach wylewów krwawych; nie stwierdzono znaczącej infiltracji komórek układu odpornościowego. Na szczycie serca znajdował się zawał pełnościenny o wymiarach 3,0 × 2,0 × 0,6 centymetra, bez oznak niedrożności tętnicy wieńcowej, który wystąpił co najmniej tydzień przed zgonem. Wszystkie ludzkie transgeny wykazywały prawidłową ekspresję w narządzie świńskim.
Autorzy badania doszli do wniosku, że przyczyną niepowodzenia ksenotransplantacji było odrzucenie zależne od przeciwciał, dotyczące głównie śródbłonka naczyniowego i rozwijające się pomimo agresywnej terapii celowanej. Sugeruje to potencjalną potrzebę dodatkowych transgenów i wczesnego rozpoczęcia kompleksowej terapii immunosupresyjnej, obejmującej tegobrupart, ekulizumab i inflimidazę – enzym usuwający przeciwciała. Ogólnie rzecz biorąc, przypadek Fossetta, podobnie jak przypadek pierwszego biorcy świńskiego serca genetycznie zmodyfikowanego, dostarczył wielu informacji dla dalszego rozwoju ksenotransplantacji serca.
Równolegle z pracami nad przeszczepianiem genetycznie zmodyfikowanych serc świńskich, trwają badania nad ksenotransplantacją zmodyfikowanych nerek świńskich. W listopadzie 2024 roku taki narząd otrzymał trzeci pacjent. Nerki genetycznie zmodyfikowane pierwszych dwóch pacjentów wszczepiły się i zaczęły funkcjonować, ale z różnych przyczyn zmarły one kilka miesięcy później.