Chińscy naukowcy przeprowadzili pierwszy na świecie przeszczep płuca od genetycznie zmodyfikowanej świni pacjentowi, u którego potwierdzono śmierć mózgu. Narząd pozostał żywy i funkcjonalny przez cały dziewięciodniowy eksperyment, choć nie udało się uniknąć powikłań. Artykuł został opublikowany w czasopiśmie „Nature Medicine”.
Idea przeszczepiania narządów zwierzęcych ludziom (ksenotransplantacja) istnieje od dawna, ale systemy edycji genomu, takie jak CRISPR-Cas, utorowały drogę do jej praktycznego zastosowania. Systemy te mogą być używane do usuwania kluczowych antygenów zwierzęcych, wprowadzania ludzkich genów do genomu i inaktywacji osadzonych wirusów w celu poprawy kompatybilności tkanek z organizmem człowieka.
Pierwsze eksperymenty z przeszczepianiem genetycznie zmodyfikowanych nerek i serc świńskich przeprowadzono u pacjentów z martwym mózgiem; od tego czasu oba narządy przeszczepiano żyjącym ludziom w Stanach Zjednoczonych. W maju 2025 roku chińscy naukowcy poinformowali o pierwszym przeszczepie wątroby świńskiej genetycznie zmodyfikowanej, oprócz własnej, pacjentowi z martwym mózgiem i niewydolnością wątroby. Narząd funkcjonował przez 10 dni, po czym został rutynowo usunięty. Płuca są trudniejszym narządem do przeszczepienia, ponieważ łatwo ulegają uszkodzeniu i są wystawione na działanie otaczającego powietrza (co zwiększa ryzyko infekcji), a podobne eksperymenty nie zostały jeszcze przeprowadzone.
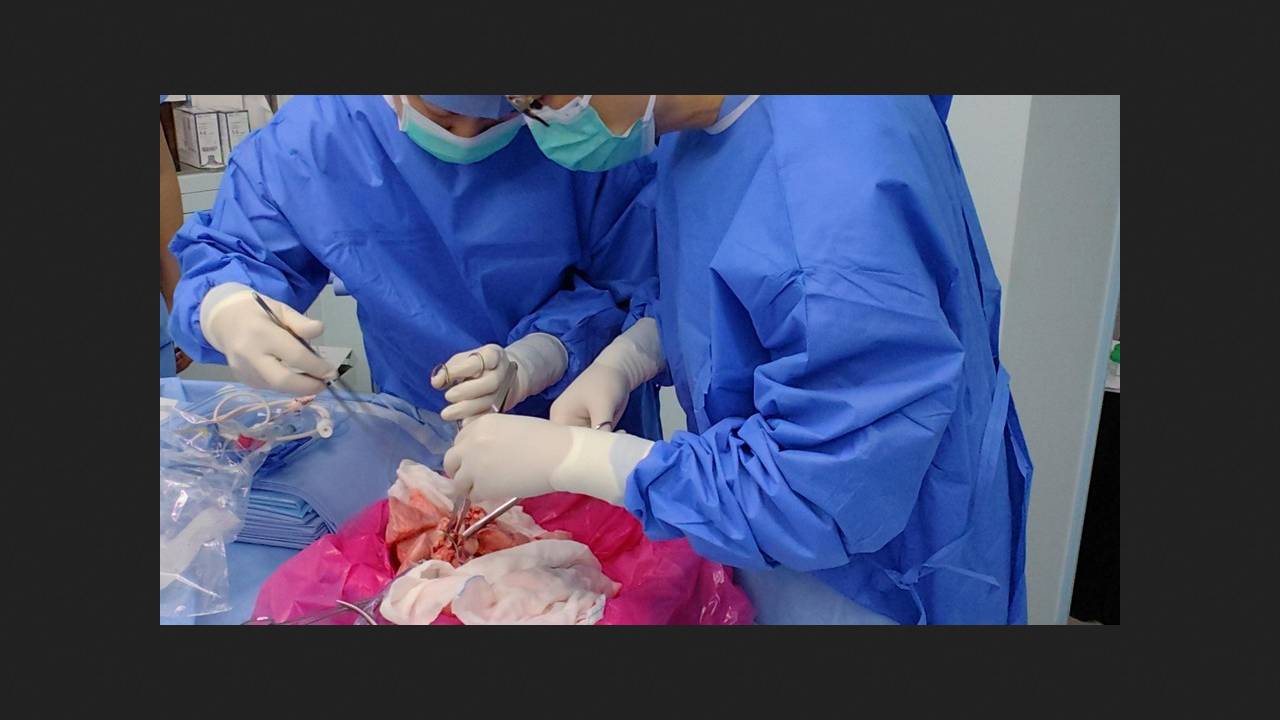
Aby przygotować się do przeszczepu, chińska firma Clonorgan Biotechnology wprowadziła sześć modyfikacji do genomu świni rasy Bama Xiang: usunęli geny GGTA1, B4GALNT2 i CMAH, odpowiedzialne za produkcję ksenoantygenów, oraz wprowadzili ludzkie geny CD55, CD46 i TBM, które regulują układ dopełniacza i modulują odpowiedź immunologiczną. Xin Xu z Uniwersytetu Medycznego w Kantonie wraz ze współpracownikami pobrali lewe płuco od 22-miesięcznego, 70-kilogramowego samca świni genetycznie zmodyfikowanej i przygotowali je do przeszczepu.
Biorcą był 39-letni mężczyzna z potwierdzoną śmiercią mózgu w wyniku krwotoku, który nie mógł oddać narządów z powodu przeciwwskazań. Operację przeprowadzono przez pośrodkową sternotomię, z zimnym niedokrwieniem trwającym 206 minut. Leczenie immunosupresyjne za pomocą tymoglobuliny króliczej, mykofenolanu mofetylu i takrolimusu rozpoczęto dzień przed operacją. Te dwa ostatnie leki, wraz z metyloprednizolonem, podawano codziennie. Pooperacyjna immunosupresja i terapia przeciwzapalna obejmowały również bazyliksymab, rytuksymab, ekulizumab, tofacytynib i belatacept.
Pacjent był poddawany ciągłemu monitorowaniu parametrów fizjologicznych, biochemicznych i immunologicznych, wykonano również biopsje przeszczepu. Po reperfuzji przeszczepione płuco pozostało żywe, wykazywało ekspresję ludzkich transgenów i funkcjonowało, z frakcją poboru tlenu wynoszącą 40%. Zdjęcia rentgenowskie wykonane po 6 i 24 godzinach wykazały zmniejszoną przezierność tkanki płucnej. Tomografia komputerowa wykonana 24 godziny po zabiegu ujawniła konsolidację w dolnej części płuca, zgodną z pierwotną dysfunkcją przeszczepu (prawdopodobnie spowodowaną uszkodzeniem po reperfuzji). W badaniu histologicznym stwierdzono ciężki obrzęk zapalny z naciekiem komórek CD68-dodatnich oraz podwyższony poziom interleukiny 6 i 10. Poziomy komórek B i NK wahały się we wczesnym okresie pooperacyjnym, natomiast poziom komórek T stopniowo wzrastał od trzeciego dnia.
W trzecim i szóstym dniu po zabiegu zaobserwowano odkładanie się immunoglobuliny G wzdłuż przegród pęcherzykowych w ksenografcie; do dziewiątego dnia ilość tych odkładów znacznie się zmniejszyła. Poziom immunoglobuliny M był początkowo niski, ale wzrósł do dziewiątego dnia, co wskazuje na wtórną aktywację układu odpornościowego. Od trzeciego dnia obserwowano również znaczną aktywację dopełniacza. Nie stwierdzono oznak aktywnej infekcji, w tym wywołanej przez patogeny świńskie. Przeszczep zachował żywotność przez 216 godzin eksperymentu; nie wystąpiło ostre odrzucenie, a parametry hemodynamiczne pozostały stabilne. Po planowanym okresie odłączono biorcę od aparatury podtrzymującej życie.
Eksperyment pilotażowy wykazał zasadniczą wykonalność ksenotransplantacji genetycznie zmodyfikowanego płuca świni bez ostrego odrzutu. Jednak pomimo modyfikacji zaobserwowano wyraźną odpowiedź immunologiczną, zarówno komórkową, jak i humoralną. Sugeruje to potrzebę udoskonalenia protokołu terapii immunosupresyjnej i przeciwzapalnej, przede wszystkim poprzez włączenie blokady szlaku sygnałowego CD40 oraz supresji interleukin i układu dopełniacza.
O ksenotransplantacji pisaliśmy szczegółowo w artykule „O świniach i ludziach”.