Chińscy i amerykańscy naukowcy poinformowali o udanym badaniu klinicznym u pacjenta z ciężką twardziną układową, wykorzystując dostępny komercyjnie preparat limfocytów NK z chimerycznym receptorem antygenowym, uzyskany z pluripotentnych komórek macierzystych indukowanych od dawców. Raport został opublikowany w czasopiśmie Cell.
Technologia chimerycznych receptorów antygenowych (więcej na ten temat w artykule „Chimera kontra rak”) została pierwotnie opracowana w celu modyfikacji limfocytów T w leczeniu nowotworów. Największy sukces odniosła w nowotworach złośliwych komórek B, ponieważ limfocyty B posiadają wysoce specyficzne antygeny, CD19 i BCMA, które stanowią dobry cel dla terapii CAR T. Podobne podejście zostało również z powodzeniem zastosowane w badaniach klinicznych w leczeniu różnych chorób autoimmunologicznych (redaktorzy czasopisma „Science”, podobnie jak „Nature”, nazwali te eksperymenty jednym z najważniejszych osiągnięć naukowych 2024 roku), ponieważ limfocyty B odgrywają kluczową rolę w ich patogenezie. Wszystkie te schematy leczenia wymagają wyizolowania autologicznych limfocytów T z krwi pacjenta, wprowadzenia transgenu CAR na wektorze wirusowym w laboratorium, namnożenia ich i ponownego wprowadzenia do organizmu. Ponadto u większości pacjentów po infuzji limfocytów CAR T rozwijają się typowe powikłania: zespół uwalniania cytokin, zespół neurotoksyczny ICANS lub zespół hiperzapalny IEC-HS o różnym nasileniu.
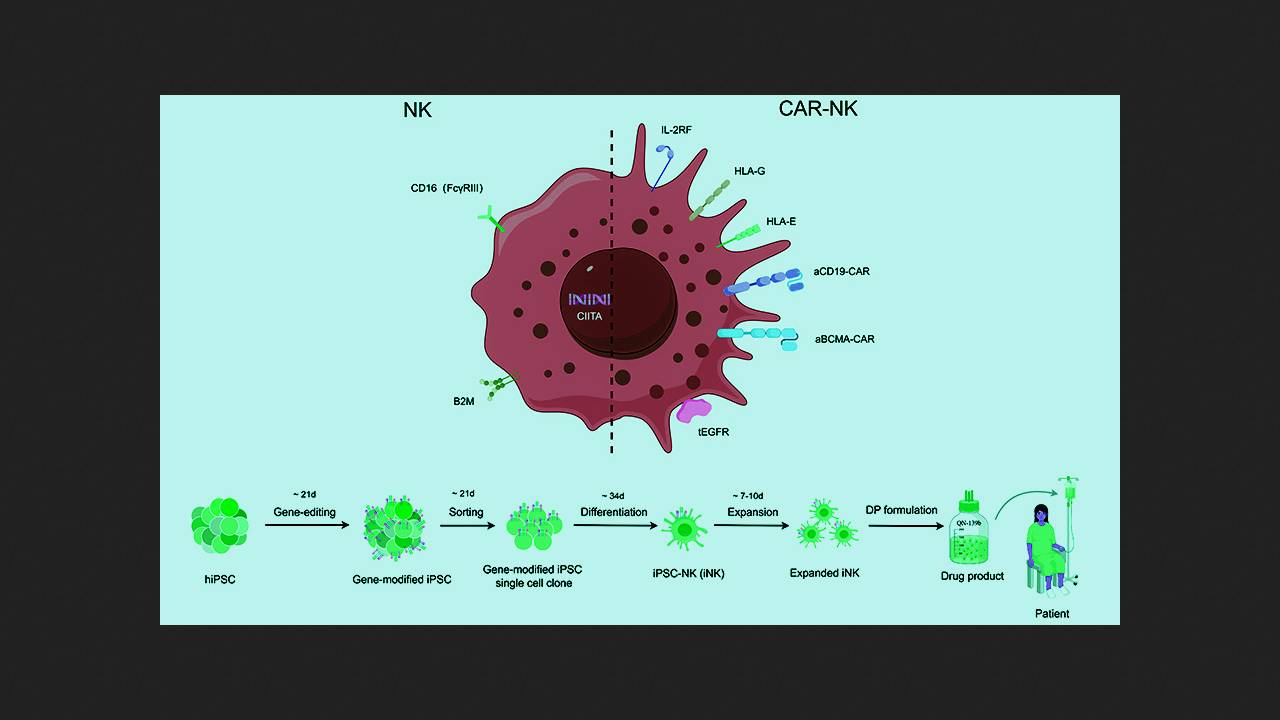
W badaniach przedklinicznych i pilotażowych, zastosowanie chimerycznych komórek NK z receptorem antygenowym (komórek CAR-NK) wykazało istotnie niższą toksyczność i potencjalnie wyższą skuteczność w porównaniu z komórkami CAR-T w leczeniu chorób wywoływanych przez limfocyty B. Huji Xu z Uniwersytetu Medycznego Marynarki Wojennej i Uniwersytetu Tsinghua, wraz z kolegami i współpracownikami z Qihangene Biotech, postanowił przetestować komórki CAR-NK w ciężkiej, opornej na leczenie chorobie autoimmunologicznej, wykorzystując do ich produkcji komórki NK pochodzące z indukowanych przez dawcę pluripotentnych komórek macierzystych (iPSC). Takie podejście ma na celu uproszczenie, obniżenie kosztów i standaryzację procedury, a także zapewnienie pacjentom gotowego do użycia leku bez konieczności oczekiwania.
При создании экспериментального препарата QN-139b исследователи генетически донорские ИПСК с помощью редактора цитозиновых оснований для нокаута генов и системы CRISPR/Cas9 для сайт-специфичной интеграции желаемых модификаций. Успешно модифицированные клетки клонировали в культуре и дифференцировали в NK-лимфоциты. Внесенные модификации включали нокаут компонент главного комплекса гистосовместимости B2M и CIITA для предотвращения распознавания Т-клетками реципиента, а также нокаут мембранного иммуноглобулина CD16 и нокин человеческих лимфоцитарных антигенов (HLA) G и E для минимизации активации NK-клетками пациента. Кроме того, в клетки внесли конструкты, экспрессирующие рецепторы интерлейкина-2 (IL-2RF) для усиления активации и персистирования и рецептор эпидермального фактора роста (tEGFR) в качестве «аварийного выключателя» анти-EGFR антителами. Полученные клетки снабдили двумя типами CAR, нацеленными на CD19 и BCMA, отобрали успешно модифицированные, оценили их проточной цитометрией и анализом на функциональные маркеры и испытали на клеточных культурах и мышах.
Для участия в клиническом эксперименте авторы работы пригласили 36-летнюю женщину с тяжелой диффузной кожной системной склеродермией. В 16 лет у нее выявили синдром Рейно и высокий уровень (+++) специфичных для заболевания анти-Scl-70 антител. К 18 годам появились утолщения кожи конечностей, прогрессирующая эритема и боль в суставах, со временем кожные проявления распространились на лицо, шею и грудную клетку. За три года до поступления у женщины выявили интерстициальное поражение легких, непосредственно перед ним — умеренный фиброз миокарда с сохранной фракцией выброса. Многолетняя терапия метилпреднизолоном, циклофосфамидом, гидроксихлорохином, метотрексатом, микофенолата мофетилом, тоцилизумабом и нидабусиба этансульфонатом прогрессирование заболевания не остановила.
После лимфодеплеции пациентке провели четыре внутривенных инфузии 600 миллионов клеток QN-139b с интервалом в три дня. Пиковая концентрация CAR-NK-клеток (270 на миллилитр крови) и их доля в общем числе лимфоцитов (2,74 процента) наблюдались на седьмой день от первой инфузии и вернулись почти на исходный уровень к двенадцатому. Сразу после инфузии произошло резкое снижение уровня периферических В-лимфоцитов, который начал восстанавливаться через два месяца и продолжал через полгода, причем с преобладанием наивных В-клеток (что свидетельствует о перезагрузке иммунной системы). Также на фоне лимфодеплеции резко снизились уровни Т- и NK-лимфоцитов, которые начали восстанавливаться через две недели и продолжали через полгода. В течение шести месяцев наблюдались прогрессирующее снижение уровней аутоантител анти-Scl-70 и анти-SSA/Ro52, нормализация уровней компонент системы комплемента C3 и C4, стабильный уровень иммуноглобулина G, существенное снижение уровней иммуноглобулинов А и М и нормализация уровня иммуноглобулина Е (до лечения в разы повышенного).
Wyniki kliniczne obejmowały redukcję objawów choroby według skali EUSTAR-AI z 3,68 do 1,33 punktu w szóstym miesiącu; poprawa w trzech lub więcej z pięciu punktów skali CRISS wyniosła co najmniej 20% w pierwszym miesiącu, 30% w drugim i 50% w trzecim. Regresję włóknienia skóry, obrzęku i rumienia obserwowano wizualnie, ultrasonograficznie, elastograficznie i histologicznie; włóknienie płuc również znacząco się zmniejszyło, a włóknienie mięśnia sercowego praktycznie ustąpiło. Kapilaroskopia wykazała znaczącą poprawę w łożysku mikrokrążenia, z dowodami na wzrost nowych naczyń. Ilościowa analiza proteomiczna krwi wykazała zwiększoną ekspresję białek związanych z angiogenezą, supresją proliferacji tkanki łącznej, reakcją na stres oksydacyjny i immunosupresją oraz zmniejszoną ekspresję związaną z aktywacją immunologiczną, stanem zapalnym i włóknieniem. Nie zaobserwowano żadnych istotnych niepożądanych reakcji na terapię, poziom markera stanu zapalnego, białka C-reaktywnego, mieścił się w granicach normy, a temperatura ciała nie wzrosła.
Wyniki pilotażowego eksperymentu klinicznego pokazują, że limfocyty CAR-NK pochodzące z komórek macierzystych dawcy można uznać za obiecującą metodę leczenia ciężkich chorób autoimmunologicznych opornych na akceptowane schematy leczenia.
Na początku 2025 roku amerykańscy naukowcy poinformowali o sukcesie pierwszych badań klinicznych gotowego leku z limfocytów CAR-NK pochodzących od dawców iPSC (FT596), w których wzięło udział 86 pacjentów z opornym lub nawracającym chłoniakiem B.