Naukowcy z siedmiu krajów przedstawili wstępne wyniki III fazy badania klinicznego ex vivo terapii CRISPR w ciężkich postaciach anemii sierpowatej i beta-talasemii u dzieci poniżej 12. roku życia. Skuteczność leku u pierwszych kilku pacjentów osiągnęła 100%, a lek był dobrze tolerowany. Raport został zaprezentowany na 67. dorocznym zjeździe Amerykańskiego Towarzystwa Hematologicznego (ASH 2025).
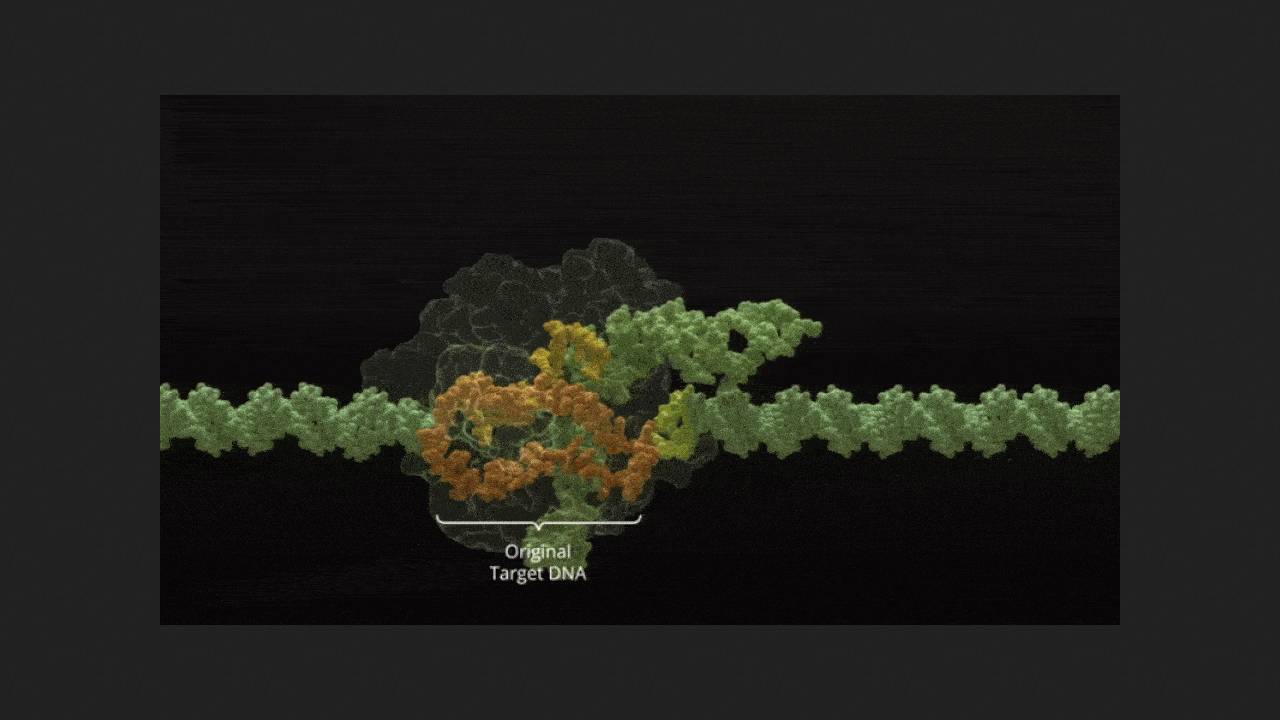
Niedokrwistość sierpowatokrwinkowa i beta-talasemia to dziedziczne schorzenia, które zaburzają prawidłową produkcję hemoglobiny A u dorosłych, prowadząc do nieprawidłowej morfologii krwinek czerwonych, anemii i innych powikłań. Exagamglogen autotemcel (exa-cel, CTX001), opracowany w celu leczenia obu tych schorzeń, stał się pierwszym na świecie zatwierdzonym leczeniem opartym na technologii edycji genomu CRISPR-Cas9. Polega ono na pobraniu od pacjenta komórek macierzystych układu krwiotwórczego, wyłączeniu genu BCL11A, który blokuje produkcję hemoglobiny płodowej F u dorosłych (która normalnie funkcjonuje u płodów), a następnie ponownym wprowadzeniu ich do organizmu. Tam dają one początek linii hematopoetycznej, która produkuje czerwone krwinki ze zdrową hemoglobiną F zamiast wadliwej hemoglobiny A. Exa-cel jest obecnie zatwierdzony do stosowania u pacjentów w wieku 12 lat i starszych.
Haydar Frangoul z Sarah Cannon Research Institute wraz ze współpracownikami prowadzi dwuletnie, otwarte, nierandomizowane badanie fazy III z udziałem dzieci w wieku 5–11 lat z niedokrwistością sierpowatokrwinkową i co najmniej dwoma ciężkimi kryzysami naczyniowo-okluzyjnymi rocznie przez dwa lata (CLIMB SCD-151) oraz dzieci w wieku 2–11 lat z beta-talasemią i transfuzjami krwi powyżej 100 mililitrów na kilogram masy ciała rocznie przez dwa lata (CLIMB THAL-141). Według stanu na kwiecień 2025 r. 10 dzieci (średni wiek 8,3 roku, 50/50 chłopców) w badaniu CLIMB SCD-151 i 13 dzieci (średni wiek 7,4 roku, 61,5% chłopców) w badaniu CLIMB THAL-141 otrzymało pojedynczą infuzję leku Exacel po mieloablacji busulfanem i późniejszej stymulacji hematopoezy.
Период наблюдения на момент презентации составил от 3,9 до 23,7 (медианно 8,3) месяца в CLIMB SCD-151 и от 2,2 до 22,7 (медианно 12,6) месяца в CLIMB THAL-141. На тот же момент ни у одного из участников CLIMB SCD-151 после инфузии не было вазооклюзивных кризов при нормальном уровне гемоглобина, и два, за которыми наблюдали не менее 12 месяцев, достигли первичной конечной точки — не имели кризов и не нуждались в стационарном лечении по их поводу в течение всего этого периода. Девять из 13 участников CLIMB THAL-141 жили без переливаний крови, и все пять, за которыми наблюдали не менее 12 месяцев, достигли первичной конечной точки — не нуждались в переливаниях весь этот период. Средний уровень гемоглобина к шести месяцам достиг и превысил 118 (в том числе фетального 110) грамм на литр и оставался стабильным.
У всех участников обоих испытаний наблюдалась стабильная экспрессия отредактированных аллелей в костном мозге и крови. Профиль безопасности в целом соответствовал опыту проведения миелоабляции и аутологичной трансплантации кроветворных стволовых клеток. У единственного пациента в CLIMB THAL-141 развилось редкое, но известное осложнение миелоабляции бусульфаном — тяжелая венооклюзионная болезнь, которая привела к полиорганной недостаточности и смерти. У остальных участников серьезных последствий лечения не наблюдалось.
Предварительные результаты клинических испытаний свидетельствуют, что эффективность и безопасность CRISPR-терапии тяжелых форм серповидноклеточной анемии и бета-талассемии у детей младше 12 лет соответствуют таковым у подростков от 12 лет и взрослых, однократное ее проведение может приводить к стойкому излечению. Окончательные результаты испытаний ожидаются позже, после их завершения участники войдут в когорту долгосрочного (до 15 лет) наблюдения CLIMB-131.
Ранее Франгул с коллегами сообщили, что у пациентов в возрасте 12 лет и старше терапия экса-целом приводит не только к улучшениям клинических характеристик, но и к многоплановому, выраженному и стойкому повышению качества жизни. В настоящее время клинические испытания проходит in vivo CRISPR-терапия наследственного ангионевротического отека, наследственной дегенерации сетчатки, неконтролируемой дислипидемии и форм транстиретинового амилоидоза с полинейропатией и кардиомиопатией, а также редактирование азотистых оснований при наследственной гиперхолестеринемии.