Niemieccy chemicy zsyntetyzowali i scharakteryzowali kilka halogenowanych soli sililowych z anionem karboranowym. Stwierdzono, że są one silniejszymi kwasami Lewisa niż alkilowane sole sililowe, ale ulegają stopniowemu rozkładowi w roztworze. Badanie zostało opublikowane w czasopiśmie „Nature Chemistry”.
Wiele reakcji z udziałem halosilanów prowadzi do powstania soli sililowych jako produktów pośrednich – związków jonowych z kationem zawierającym krzem trójwartościowy. Przez długi czas chemikom nie udawało się uzyskać tej soli w czystej postaci, ale w 2002 roku naukowcom udało się w końcu po raz pierwszy wiarygodnie scharakteryzować sól sililową. Składała się ona z kationu trimetylosililowego i niekoordynującego anionu karboranowego. Od tego czasu chemicy podejmują próby wytworzenia soli sililowych, w których krzem jest związany nie tylko z atomami węgla, ale także z atomami innych pierwiastków.
Martin Oestreich i jego współpracownicy z Politechniki Berlińskiej postanowili podjąć próbę wytworzenia halogenowanych soli sililowych. W tym celu wzięli diizopropylochlorosilan, w którym dwie grupy izopropylowe, atom wodoru i atom chloru są przyłączone do atomu krzemu, i zmieszali go z solą karboranową kationu trifenylometylowego w deuterobenzenie. Pomysł naukowców polegał na tym, że kation oderwie atom wodoru od silanu, tworząc pożądaną sól podstawioną chlorem. Zamiast tego badacze zaobserwowali powstawanie soli z innym kationem, w której dwie grupy izopropylowe i atom wodoru były przyłączone do krzemu.
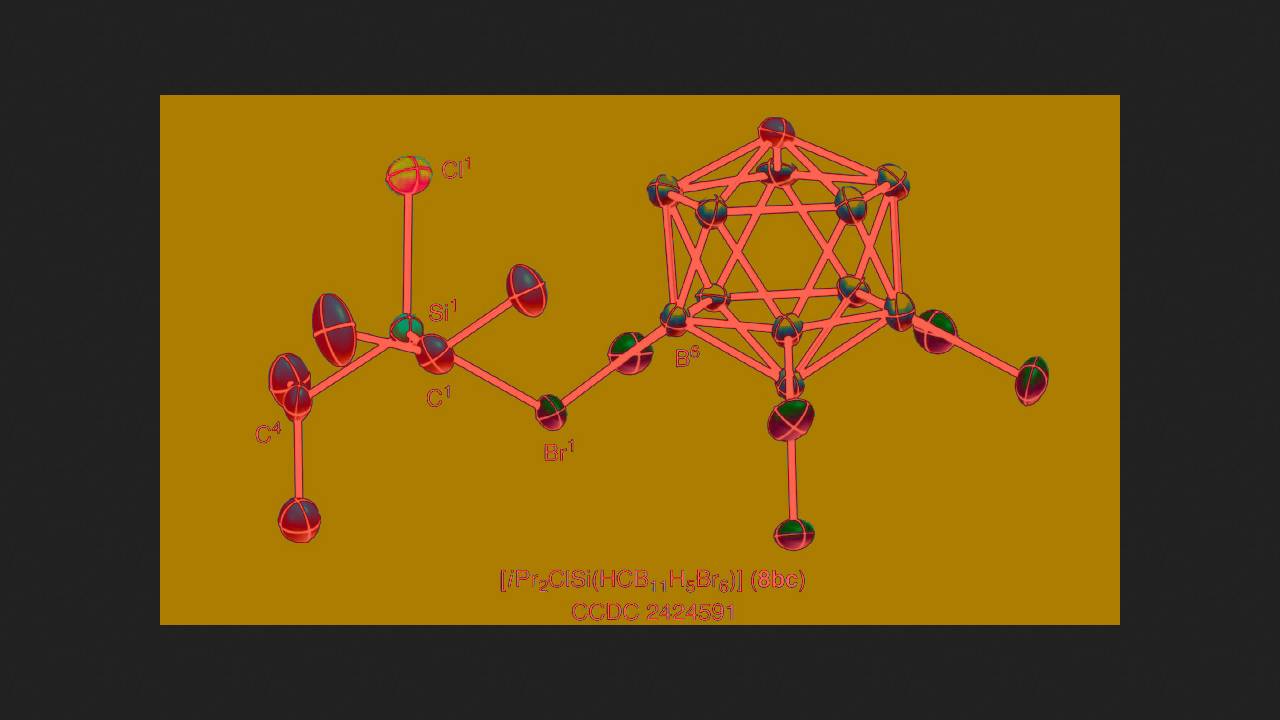
Następnie postanowili zastosować inną metodę syntezy: chemicy zmieszali wyjściowy silan z solą, w której protonowany benzen pełnił rolę kationu. W tym przypadku reakcja przebiegła zgodnie z oczekiwaniami – uwolnił się wodór, tworząc sól z kationem zawierającym wiązanie krzem-chlor oraz dwie grupy izopropylowe. Chemicy scharakteryzowali ją za pomocą spektroskopii NMR i analizy dyfrakcji rentgenowskiej.
Stosując tę samą metodę, naukowcy uzyskali sole sililowe podstawione fluorem, bromem i jodem. Były one stabilne w postaci stałej w atmosferze obojętnej, ale stopniowo rozkładały się w roztworze, szczególnie szybko w świetle.
Chemicy postanowili następnie zbadać siłę otrzymanych soli sililowych jako kwasów Lewisa, czyli ich powinowactwo do wolnych par elektronowych. W tym celu naukowcy wykorzystali spektroskopię NMR adduktów ich soli z fluorowanym benzonitrylem, a także obliczenia chemii kwantowej. Okazało się, że spośród wszystkich wcześniej otrzymanych soli sililowych, sole halogenowane są najsilniejszymi kwasami Lewisa.
W ten sposób naukowcy po raz pierwszy zsyntetyzowali halogenowane sole sililowe i zbadali ich właściwości kwasowe. Według autorów artykułu, powstałe związki należą do najsilniejszych kwasów Lewisa, jakie kiedykolwiek wyizolowano w czystej postaci.
Związki krzemoorganiczne, w tym silany, są najczęściej wykorzystywane do produkcji polimerów. Niedawno chemicy we Francji nauczyli się przekształcać te polimery z powrotem w monomeryczne chlorosilany, a konkretnie dimetylochlorosilan.