Brytyjscy naukowcy przeanalizowali strukturę ściany komórkowej gronkowca złocistego opornego na metycylinę i doszli do wniosku, że geny oporności umożliwiają mu podział w obecności antybiotyków, wykorzystując alternatywną architekturę ściany komórkowej. Raport z badania został opublikowany w czasopiśmie „Science” wraz z artykułem redakcyjnym poświęconym temu badaniu.
Po powszechnym stosowaniu penicyliny beta-laktamowej w latach 40. i 50. XX wieku, oporne szczepy gronkowca złocistego (Staphylococcus aureus) zaczęły się szybko rozprzestrzeniać z powodu produkcji beta-laktamaz. Aby je zwalczać, w 1959 roku wprowadzono metycylinę – pochodną penicyliny, której ten enzym nie niszczy. Jednak w kolejnej dekadzie odnotowano zakażenia wywołane przez gronkowca złocistego opornego na metycylinę (MRSA), który obecnie stanowi jedną z najgroźniejszych bakterii opornych na antybiotyki, powodując ponad 100 000 zgonów rocznie.
Antybiotyki beta-laktamowe działają poprzez blokowanie białek wiążących penicylinę (PBP), enzymów odpowiedzialnych za tworzenie peptydów ścian komórkowych bakterii. Gronkowiec złocisty (Staphylococcus aureus) ma cztery takie białka, ale tylko PBP1 i PBP2 są kluczowe dla budowy ściany komórkowej. MRSA posiada nietypowy dla gatunku wariant PBP2a o niskim powinowactwie do większości beta-laktamów. Pochodzi on od innych gatunków Staphylococcus, jest kodowany przez gen mecA i przenoszony horyzontalnie przez kasety genów SCCmec różnego typu. Może on pełnić funkcje transpeptydazowe PBP2, ale nie PBP1. Ta adaptacja zapewnia ochronę przed niskimi stężeniami metycyliny, ale około jedna na 10 000 komórek MRSA wykazuje wyjątkowo wysoką oporność z powodu dodatkowych mutacji w genach potencjonujących (pot), w tym kodujących podjednostki polimerazy RNA (rpo*). W obecności antybiotyku komórki te ulegają pozytywnej selekcji.
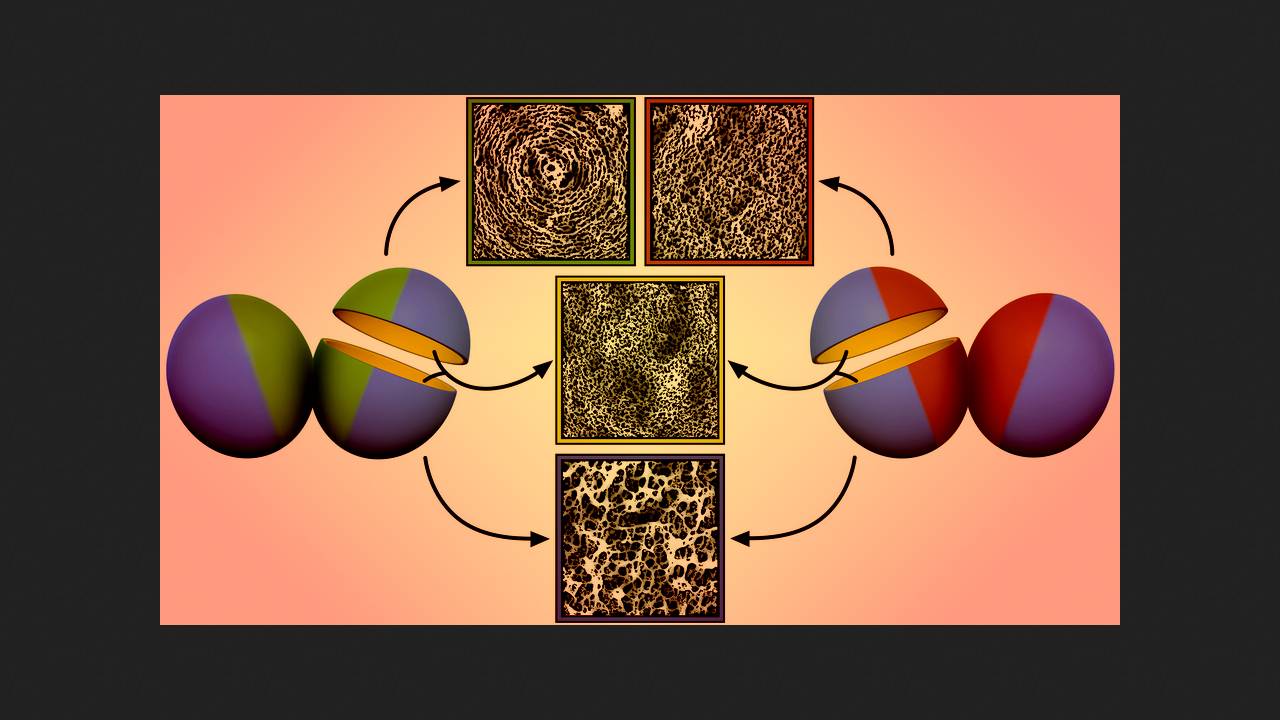
Simon Foster z Uniwersytetu w Sheffield i współpracownicy wykorzystali mikroskopię sił atomowych o wysokiej rozdzielczości (AFM) do zbadania struktury ściany komórkowej szczepu Staphylococcus aureus wrażliwego na antybiotyki (MSSA) oraz tego samego szczepu wyposażonego w gen mecA (tj. MRSA). W przypadku braku antybiotyków, peptydoglikany obu bakterii na powierzchni zewnętrznej miały strukturę gruboziarnistą z dużymi porami, natomiast na powierzchni wewnętrznej, gdzie są syntetyzowane, tworzyły znacznie gęstszą sieć. Wraz z formowaniem się nowej ściany, pełniącej funkcję bariery między komórkami potomnymi podczas podziału, jej zewnętrzne peptydoglikany fałdowały się w charakterystyczne koncentryczne okręgi.
Под действием 1,5 микрограмма метициллина на миллилитр среды, что немного меньше минимальной подавляющей концентрации (МПК) для обычного MRSA, в стенке MSSA появлялись крупные отверстия и клетка погибала. У mecA+ MRSA в этих условиях в перегородке между клетками наружные пептидогликаны не формировали концентрическую структуру, а представляли собой плотную однородную сеть, при этом толщина стенки снижалась. Такая же утрата концентрических окружностей с формированием плотной сети наблюдалась у высокоустойчивого штамма MRSA, несущего мутацию rpoB* помимо гена mecA, при концентрации антибиотика 25 микрограмм на миллилитр (смертельной для MSSA и mecA+ MRSA), однако у него стенка утолщалась с образованием дополнительной выпуклости посередине. Аналогичные паттерны формирования стенки в присутствии антибиотика демонстрировали различные клинически значимые высокоустойчивые штаммы MRSA с разными типами SCCmec.
Выяснив это, авторы работы, экспериментируя с различными штаммами золотистого стафилококка, провели систематическое исследование молекулярных механизмов обычного (в отсутствие антибиотиков) и альтернативного (в их присутствии у устойчивых штаммов) способов деления клеток. Они выяснили, что за рост концентрических структур пептидогликанов в процессе деления отвечает только чувствительный к метициллину PBP1. Мутация rpoB может компенсировать траспептидазную активность этого белка, и именно она отвечает за формирование плотной сети пептидогликанов. В комбинации с замещением активности PBP2 устойчивым PBP2a это исключает необходимость в чувствительных PBP1 и PBP2, обеспечивая альтернативный способ деления и высокую резистентность к метициллину. Аналогично мутантному rpoB может действовать pot мутация гена rel, который отвечает за стрессовую реакцию бактерий на дефицит нутриентов, и обе этих мутации повышают концентрацию в клетке алармона гуанозинтетрафосфата.
В завершение авторы работы показали, что некоторые соединения могут вернуть MRSA чувствительность к метициллину в культуре при определенных мутациях: кломифен и спермин — при mecA+ pbp2* и mecA+ pbp2* rpoB*, но не pbp1* rpoB*; норгестимат — pbp1* rpoB* и mecA+ pbp2*, но не mecA+ pbp2* rpoB*, эпикатехина галлат — при всех трех. Имеет ли это клиническое значение, а также используют ли другие бактерии альтернативный синтез клеточной стенки при делении в присутствии антибиотиков, предстоит выяснить в дальнейших исследованиях.
Ранее было показано, что кожа людей может противостоять проникновению MRSA за счет выработки интерлейкина-8, из-за чего он может быть комменсалом в кожной микробиоте, а гаплонедостаточность гена OTULIN, напротив, предрасполагает к тяжелым стафилококковым инфекциям. При этом бета-лактамный цефалоспорин пятого поколения цефтобипрол пока сохраняет активность в отношении MRSA.