Brytyjscy chemicy uzyskali 48-węglowy pierścień w roztworze. Aby to osiągnąć, owinęli trzy inne pierścienie wokół pierścienia węglowego, aby zapobiec reakcji cząsteczek cyklokarbonu ze sobą. Powstały cyklokarbon był stabilny w roztworze w niskich temperaturach, ale rozkładał się natychmiast po odparowaniu rozpuszczalnika, piszą autorzy badania w czasopiśmie Science.
W cząsteczkach cyklokarbonów atomy węgla są połączone w pierścień wiązaniami wielokrotnymi. Związki te nie zawierają innych atomów, dlatego można je uznać za odrębną odmianę alotropową węgla. W roztworze lub fazie stałej w temperaturze pokojowej substancje te są niestabilne i szybko się rozkładają, dlatego zazwyczaj otrzymuje się je na substratach w temperaturach poniżej 10 kelwinów.
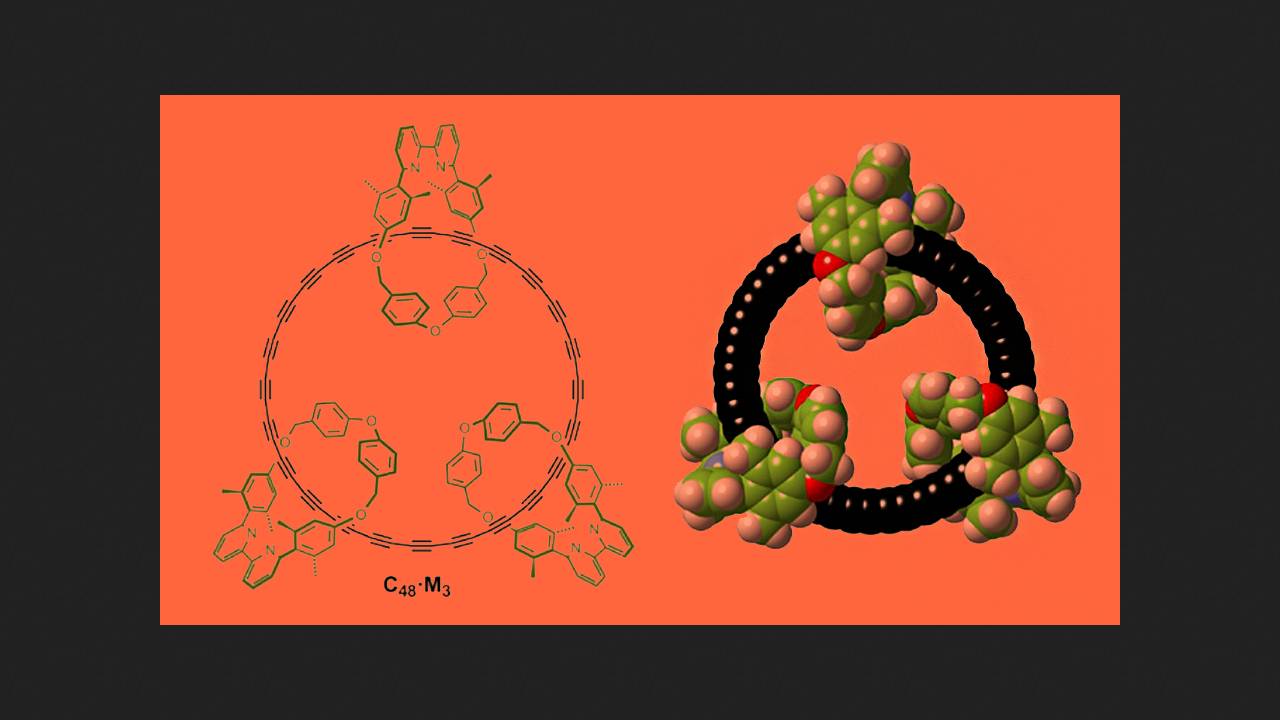
Chemicy pod kierownictwem Harry'ego L. Andersona z Uniwersytetu Oksfordzkiego postanowili uzyskać cyklokarbon w roztworze, pomimo jego niestabilności. Pomysł naukowców polegał na syntezie pochodnej cyklokarbonu, w której kilka cyklicznych cząsteczek organicznych byłoby owiniętych wokół łańcucha węglowego. Chemicy postawili hipotezę, że cząsteczki te będą chronić łańcuch węglowy przed kolizjami z sąsiednimi cząsteczkami, a w konsekwencji przed szybkim rozkładem.
Naukowcy rozpoczęli syntezę zasady cyklokarbonowej. Najpierw zabezpieczyli reaktywne wiązania potrójne w materiałach wyjściowych, koordynując je z kobaltem. Następnie, z powstałych alkinów, naukowcy zbudowali katenan, w którym zasada cyklokarbonowa z zabezpieczonymi wiązaniami potrójnymi była otoczona trzema pierścieniami organicznymi.
Następnie naukowcy przystąpili do usuwania zabezpieczenia kobaltowego z wiązań potrójnych. W tym celu przetestowali liczne warunki reakcji, ostatecznie decydując się na mieszaninę kwasu meta-chloronadbenzoesowego i bipirydyny. Zmieszali ją z katenanem w dichlorometanie i oczyścili powstały produkt za pomocą chromatografii żelowej. Widma masowe powstałego roztworu chromatograficznego potwierdziły powstanie katenanu z wolnym 48-członowym pierścieniem węglowym w rdzeniu. Spektroskopia NMR węgla i wodoru również to potwierdziła.
Cyklokarbon chroniony dodatkowymi pierścieniami okazał się stosunkowo stabilny w rozcieńczonym roztworze – w temperaturze pokojowej jego okres półtrwania wynosił 92 godziny. Jednak gdy chemicy próbowali uzyskać wolny cyklokarbon bez dodatkowych pierścieni i struktury katenanu, stosując tę samą metodę, rozkład postępował bardzo szybko – i naukowcy nie byli w stanie uzyskać wiarygodnych dowodów jego powstania.
W ten sposób chemicy po raz pierwszy uzyskali 48-atomowy cyklokarbon splątany w katenanie w roztworze. Naukowcy zauważają, że zastosowana przez nich metoda stabilizacji może być w przyszłości przydatna do innych niestabilnych substancji.
Niedawno informowaliśmy o tym, jak chemicy wykorzystali skaningowy mikroskop tunelowy do manipulowania atomami i wytworzenia 18-członowego cyklokarbonu.